Application Note T細胞と患者由来オルガノイド間の
相互作用を定量化する新規ワークフロー
- T細胞とオルガノイドのin vitroにおける相互作用を評価するための、導入が容易なワークフロー
- T細胞がオルガノイドに引き寄せられる距離を解析するための新規手法
- タイムラプス撮像およびハイコンテントイメージングにおける自動化技術の活用
PDF版(英語)
はじめに
Zhisong Tong|リサーチサイエンティスト|モレキュラーデバイス
Angeline Lim|シニアアプリケーションサイエンティスト|モレキュラーデバイス
免疫療法は、がん治療の一手法としてますます注目を集めています。これらの治療法には、キメラ抗原受容体(CAR)を導入したT細胞(CAR-T細胞)、腫瘍浸潤リンパ球(TIL)、その他の遺伝子改変T細胞を用いて、がん細胞を特異的に標的とする方法が含まれます。免疫療法は血液がんの治療において大きな成功を収めていますが、固形腫瘍に対する有効性は依然として限定的です。この成功率の低さの一因として、固形腫瘍の微小環境(TME)が挙げられます。TMEでは抑制性サイトカインがT細胞の腫瘍殺傷能を制限するため、TMEがT細胞応答に与える影響を理解することは、効果的ながん治療法の開発に不可欠です。
3Dの患者由来オルガノイド(PDO)を用いる利点は、従来の2D単層培養では再現できないTME内の物理的・化学的刺激が存在する点にあります。研究によれば、PDOは元の腫瘍と類似した薬剤応答を示すことが確認されており、治療効果の向上にPDOを活用する価値が示唆されています。つまり、PDOは生理学的および病理学的により関連性の高いがんモデルであり、原発腫瘍の基本的な特徴を再現するため、T細胞による殺傷効果を評価する上で2D細胞モデルよりも適しています。
PDOの使用に関連する利点がある一方で、創薬への広範な応用には依然として大きな障壁があります。オルガノイドの作製は高コストかつ非常に手間のかかる工程であり、培養には熟練した手技が求められ、操作者間で大きなばらつきが生じる可能性があります。こうした課題に対応するため、大規模なアプリケーションにおけるPDOの利用を可能にする半自動化バイオプロセスが開発され、アッセイ対応オルガノイドの大規模増殖が実現されています。 本研究では、PDOを用いて固形腫瘍におけるT細胞浸潤の有効性を評価する手法を開発しました。バイオリアクターで増殖させた患者由来の大腸がんオルガノイド(CRC)を用い、活性化したヒト末梢血単核細胞(PBMC)をCellTrackerで染色し、MitoTrackerで染色したCRCに加え、96ウェルのマイクロタイタープレートで3日間、4時間ごとにハイコンテントイメージャーで観察を行いました。T細胞の浸潤を定量化するために、各T細胞から最も近いオルガノイドまでの距離を測定する画像解析手法を開発しました。解析の結果、刺激されたT細胞は非刺激T細胞よりもオルガノイドとの距離が短く、より強い相互作用を示すことが明らかとなりました。これらの結果は、バイオリアクターで増殖させたオルガノイドが、T細胞ベースの大規模スクリーニングに有用であることを示しています。
使用装置および方法
ワークフロー
バイオリアクターで増殖させた患者由来の大腸がん(CRC)オルガノイドは、凍結保存後に解凍し、80% Matrigel®(成長因子低減タイプ、Corning)中で培養しました。48時間後、オルガノイドを回収し、MitoTracker Red(Thermo Fisher Scientific、メーカー推奨濃度)で染色した後、3% Matrigelに再懸濁し、384ウェルの平底プレート(超低接着、Corning)に播種しました。凍結保存されたPBMCまたはT細胞は、PMA/iで6時間刺激した後、CellTracker Green(Thermo Fisher Scientific、メーカー推奨濃度)で染色し、CRCオルガノイドに添加して共培養を行いました。タイムラプスライブイメージングには、ImageXpress® Confocal HT.ai ハイコンテントイメージングシステム(モレキュラーデバイス)を使用しました。本システムはスピニングディスクコンフォーカルとsCMOSカメラを搭載しており、4時間ごとに撮影を行いました。
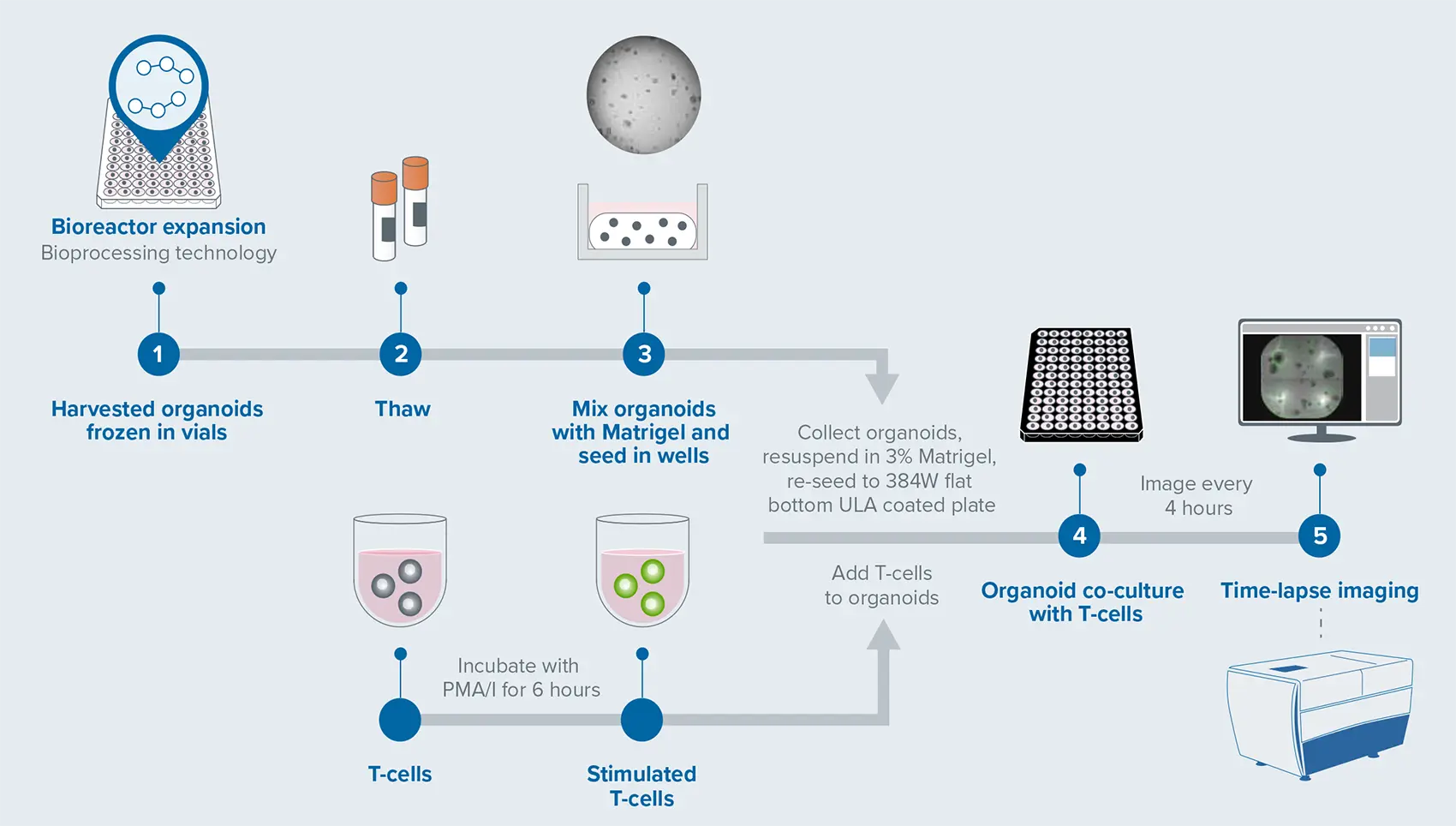
図1. T細胞とCRC PDOの相互作用ワークフロー(非刺激T細胞をコントロールとして使用)
自動化設定
オルガノイドとT細胞の共培養をモニタリングするため、インキュベーターとハイコンテントイメージャーからなる自動化ワークセル(図2のオレンジ枠)を使用しました。培養中のオルガノイドの定期的な観察には、Generaスケジューリングソフトウェア(RETISOFT)を用いました。プロトコルでは、インキュベーターからプレートを取り出し、ImageXpress Confocal HT.aiに搬送して4時間ごとにオルガノイドを撮像(Zスタック取得、10倍対物レンズ)し、PreciseFlex400ロボットアーム(Brooks)を用いてプレートを再びインキュベーターに戻す工程が含まれております。
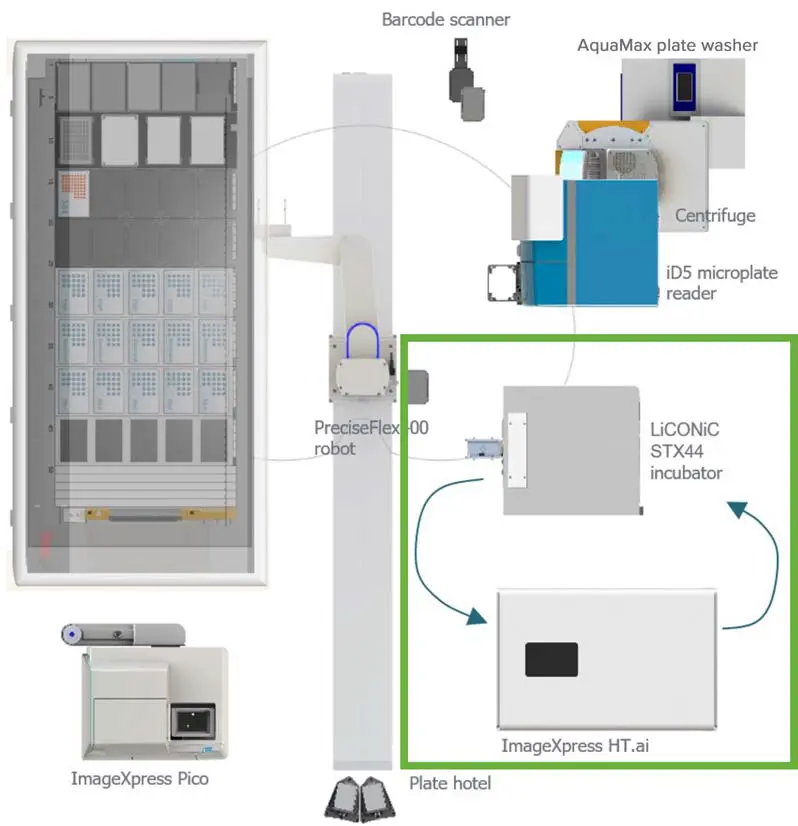
図2.自動化ワークセルのレイアウト この標準化されたワークフローには、液体分注装置(Hamilton)、ロボットアーム(Brooks)、インキュベーター(LiCONiC)、ImageXpress Confocal HT.ai システム(モレキュラーデバイス)、ImageXpress Pico 自動細胞イメージングシステム(モレキュラーデバイス)、SpectraMax® iD5 マルチモードマイクロプレートリーダー(モレキュラーデバイス)、AquaMax® マイクロプレートウォッシャー(モレキュラーデバイス)、プレートホテル、遠心機、バーコードスキャナーが含まれています。図中の曲線矢印は、培養中の細胞をモニタリングするプロセスの一例を示しており、プレートがインキュベーターからImageXpress Confocal HT.ai システムに移動して撮像され、その後再びインキュベーターに戻される流れを表しています。
アッセイの最適化
研究により、T細胞は高密度のコラーゲンマトリックス内では移動しにくいことが示されています *2。オルガノイドは高濃度(80%)のMatrigel中で培養されており、これがT細胞の移動を妨げる可能性があるため、まずオルガノイドの培養を維持するために必要最小限のMatrigel量を検討し、アッセイの最適化を行いました。理想的には、使用するMatrigel量はCRCオルガノイドの構造を維持しつつ、T細胞が自由にオルガノイドへ移動できる程度である必要があります。80% Matrigel中のCRCオルガノイドはサイズが増加し続けましたが、3%、5%、10% Matrigel中のオルガノイドはサイズに有意な変化を示しませんでした。興味深いことに、培地のみで培養したCRCオルガノイドはわずかにサイズが増加しました。これは、Matrigelの物理的特性(例えば硬さ)がオルガノイドの形態に影響を与えている可能性があります *1。これらの結果から、T細胞の浸透効率を最大化しつつ、オルガノイドの構造を維持するために、3% Matrigelを使用することにしました。
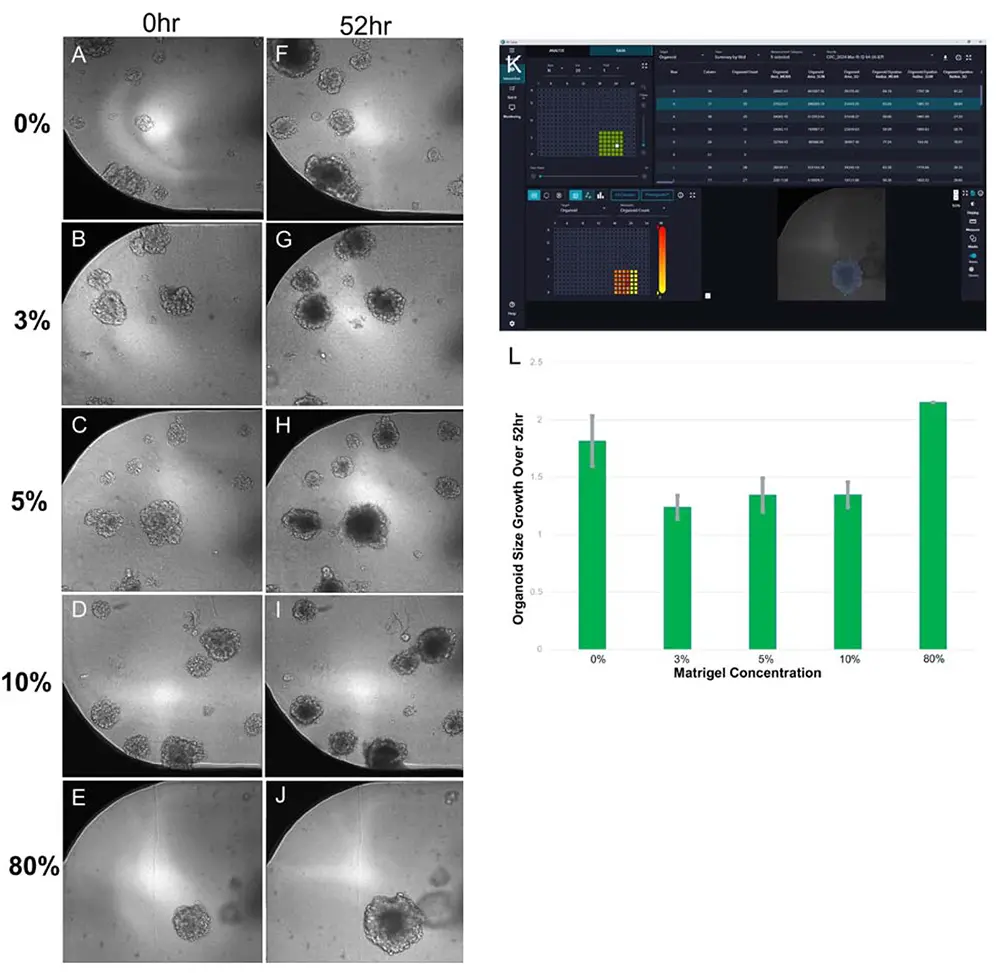
図3. オルガノイドとMatrigel濃度の関係 (A) 0%(培地のみ)、(B) 3%、(C) 5%、(D) 10%、(E) 80% Matrigelで培養開始時(0時間)の混合状態、(F)〜(J) 各濃度で52時間後のオルガノイドの成長、(K) IN Carta®画像解析ソフトウェアによるオルガノイド面積の測定、(L) Matrigel濃度別の52時間における平均成長率(誤差棒は標準偏差)
結果
T細胞とPDOの相互作用
培養中、T細胞とオルガノイドは異なる運動性を示しました。図4では、T細胞とCRCオルガノイド間の相互作用の進行が示されています。刺激されたT細胞はオルガノイド周囲に集積する傾向があり(図4A)、非刺激T細胞ではそのような集積は見られませんでした。非刺激条件ではオルガノイドの位置は変化しませんでしたが、刺激されたT細胞はオルガノイドを培養中に移動させるような挙動を示しました(図4Aの白矢印参照)。
T細胞集積の解析
オルガノイド周囲のT細胞数を定量化するため、MetaXpress®ハイコンテント画像取得・解析ソフトウェアのカスタムモジュールエディター(CME)を用いて、各T細胞から最も近いオルガノイドまでの距離を測定いたしました(オルガノイド内部のT細胞は除外)。解析対象は、オルガノイドから50 µm以内に存在するT細胞のみとしました。解析の結果、T細胞は時間経過とともにオルガノイドの縁に局在することが示されました。オルガノイド縁へのT細胞集積は、処理後24時間(タイムポイント6、図5)で最大となりました。一方、非刺激T細胞はオルガノイド周囲に特異的な集積を示さず、ウェルの端部に集まる傾向が見られました。
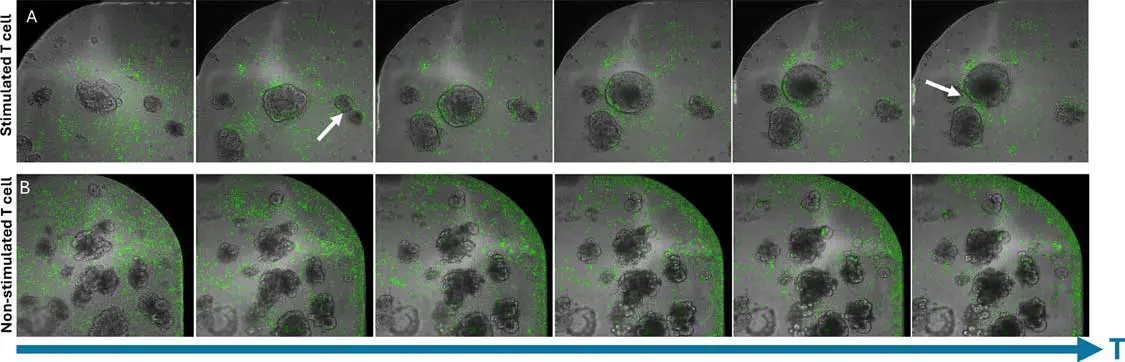
図4. T細胞の集積挙動 (A) 刺激T細胞はオルガノイド周囲に集積し、時間とともにオルガノイド同士を引き寄せるような挙動を示し、(B) 非刺激T細胞はウェルの端部に集積し、オルガノイドには影響を与えません
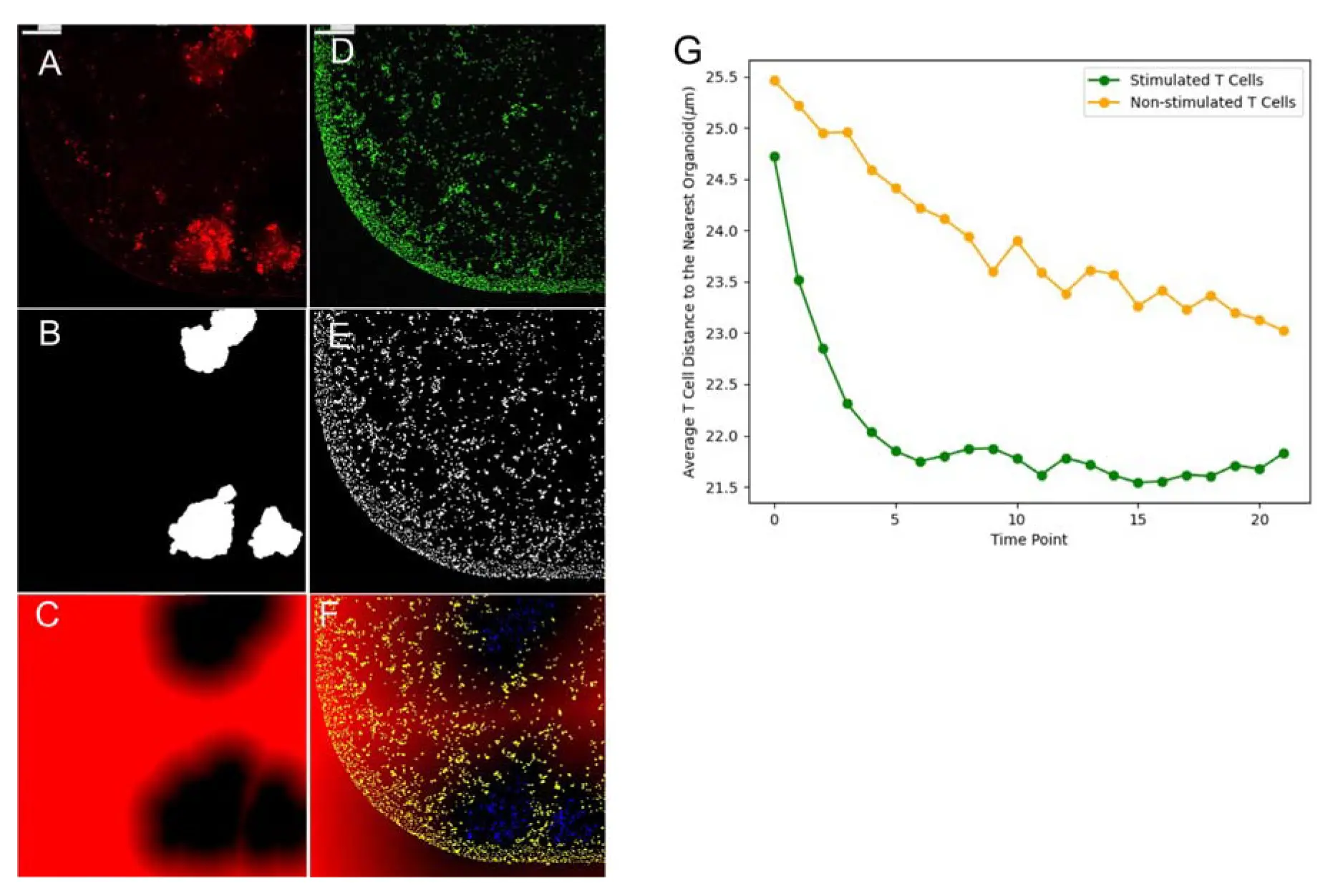
図5. T細胞とオルガノイドの距離解析手法 (A) MitoTracker Redによるオルガノイド内ミトコンドリアの染色、(B) MitoTracker染色から生成されたオルガノイドマスク(境界の定義、 (C) 各画素が最近傍のオルガノイド境界までの距離を示す16ビットグレースケール画像、(D) CellTracker GreenによるT細胞の染色、(E) CellTracker染色から生成されたT細胞マスク、(F) (C)と(E)を重ね合わせて、各T細胞から最近傍オルガノイドまでの距離を測定、(G) 同一処理群(刺激群10ウェル、非刺激群5ウェル)における全タイムポイントでのT細胞平均距離
結論
- ImageXpress Confocal HT.ai ハイコンテントイメージングシステムを用いて、T細胞とオルガノイドの相互作用をタイムラプスで観察しました。
- カスタムモジュールエディターを使用し、オルガノイド周縁部へのT細胞の集積を解析しました。
- T細胞とオルガノイド間の相互作用を定量化するための新規ワークフローを提案します。
参考文献
- Quantification of Visco-Elastic Properties of a Matrigel for Organoid Development as a Function of Polymer Concentration
- Xiangming Liu, Yuemei Qiao, JianFeng Chen, Gaoxiang Ge, Basement membrane promotes tumor development by attenuating T cell activation, Journal of Molecular Cell Biology, Volume 14, Issue 2, February 2022
PDF版(英語)