Application Note β-cateninモジュレーター
核内トランスロケーション解析アッセイ
- 再現性のある表現型測定
- 画像品質を損なわないハイスループット取得
- インタラクティブなデータプレビューによる解析セットアップ時間の短縮
- 堅牢な測定を実現する独自の統計アプローチ
PDF版(英語)
はじめに
双極性障害(BD)は、世界人口の約1%に影響を及ぼす遺伝性の高い精神疾患です。1949年に躁病治療に初めて使用されて以来、リチウムは現在でもBD治療に最も一般的に処方される薬剤です。しかし、症例の50%ではリチウム治療に良好な反応が見られず、毒性や副作用は依然として重大な懸念事項です。
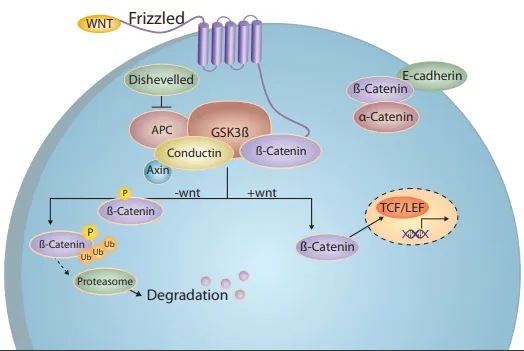
リチウムの作用機序の治療的基盤は完全には解明されていませんが、Glycogen Synthase Kinase 3(GSK-3)の活性を阻害し、Wntシグナル伝達経路を活性化することが知られています。これにより、プロテアソームによるß-cateninの分解が直接的および間接的に抑制されます。Wnt/ß-cateninシグナル伝達の新しいタンパク質や薬理学的制御因子は、ß-catenin分解を阻害または解除する能力に基づいて同定できます。この評価は、細胞内に蓄積するß-catenin量を測定することで行われます。この定量化は、検出と解析を改善するためにハイスループットかつ体系的なイメージング手法で効率化できます。この目的のために、1856種類のヒトで使用経験のある化合物ライブラリーを用い、細胞ベースのレポーターアッセイとハイコンテントスクリーニングプラットフォームを組み合わせ、Wntシグナル経路の阻害に応答した核内ß-cateninの蓄積を測定しました。
ハイスループットワークフローのためのエンドポイントアッセイの準備
ヒトß-cateninと強化型緑色蛍光タンパク質(EGFP)を融合発現するように設計されたU2OS細胞を、384ウェルマイクロプレートに1ウェルあたり1500細胞で播種しました。細胞を37℃で48時間培養後、スクリーニングライブラリーの化合物を添加しました。さらに24時間インキュベートした後、Hoechst 33342 DNA染色剤(5 μg/mL)を含む4%パラホルムアルデヒドで固定しました。これらの結果に基づき、スクリーニングライブラリーから得られた活性化合物の1つをさらに評価し、その結果を以下に示します。
速度を損なわずに高い統計的有意性を得るために多数の細胞をイメージング
ハイコンテントイメージングはImageXpress® Microシステムを使用して実施しました。EGFP蛍光とHoechst核染色を測定するため、10倍対物レンズで1ウェルあたり4サイトを取得しました。10倍の倍率で、各視野で1000細胞以上のデータを取得し、統計的に有意な解析結果を一貫して得ることができました。
化合物刺激に対する表現型応答の同定
ß-catenin-EGFP発現細胞株の基底条件(コントロール)下での画像では、ß-catenin-EGFPレポーターはプロテアソームによる恒常的な分解のため、細胞質や核内にシグナルは見られませんでした。代わりに、細胞膜内のカドヘリン残存サブポピュレーションとの相互作用による淡い膜局在シグナルが確認されました(図2、左)。Wntシグナル経路の阻害、例えばGSK-3ß阻害剤の処理により、ß-catenin-EGFPレポーターは濃度依存的に核内に蓄積しました(図2、右)。
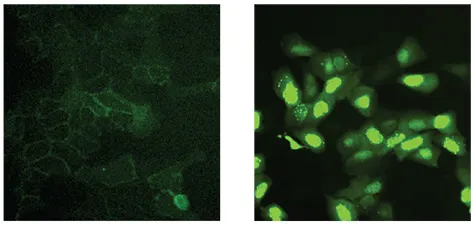
図2. 10倍Plan Fluor対物レンズで取得した拡大画像。正常なWnt発現に対する応答では、蛍光EGFPは細胞膜に淡く分散し、核内には蓄積しない(左)。GSK-3ß阻害剤処理後、Wntシグナル阻害によりß-catenin-EGFPは核内へトランスロケーションする(右)。
インタラクティブで柔軟なソフトウェアを用いたデータ解析
MetaXpress®ソフトウェアのTranslocation-Enhanced Application Moduleを使用し、核を識別して、細胞内の異なるコンパートメントにおけるß-catenin-EGFP蛍光量を核に対して定量しました(図3)。

図3. Translocation-Enhanced Application Moduleでは、核染色から核コンパートメントを作成し、核マスクから細胞質コンパートメントを生成します(上)。MetaXpressソフトウェアは、コンパートメント間のサイズや境界を正確に定義するための領域測定の調整や、陽性・陰性判定のカットオフ設定を柔軟に行うことができます(下)。
核コンパートメントのセグメンテーションはHoechst核染色領域から生成されました。この核マスクは、EGFPの第2波長と組み合わせて、アッセイの仕様に応じてサイズや幅を調整可能なコンパートメントを作成しました。これにより、核、細胞質、細胞膜など各コンパートメント内の蛍光強度を定量・解析できます。インタラクティブモジュールはパラメータ調整時に即時フィードバックを提供し、各アッセイに合わせた解析の微調整を可能にします。
MetaXpressソフトウェアのTranslocation-Enhanced Application Moduleでは、さまざまなアルゴリズムを用いて細胞のスコアリング方法をカスタマイズできます。特定の細胞コンパートメントにおける各波長の平均または総強度を細胞単位または画像単位で測定するだけでなく、細胞全体領域における2種類の染色強度からPearsonの相関係数を算出できます。この係数は-1(逆相関)から1(完全相関)までの範囲で、今回の場合、係数が高いほどß-catenin-EGFPが核内へトランスロケーションしたことを示します(図4)。
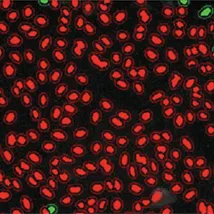
低核内トランスロケーション
高核内トランスロケーション
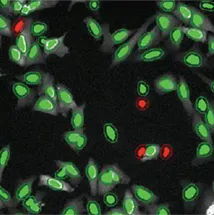
図4. MetaXpress Segmentationソフトウェアで作成されたマスク。DMSO処理陰性コントロール(左)とMG132処理陽性コントロール(右)。Translocation-Enhanced Application Moduleを使用。Pearson相関係数が0.5以上の場合は陽性(緑)、0.5未満の場合は陰性(赤)としてスコアリング。
その後、核コンパートメントと細胞質の平均強度比をプロットして用量反応曲線を作成しました(図5)。アッセイの堅牢性はZ’値の算出により評価しました。
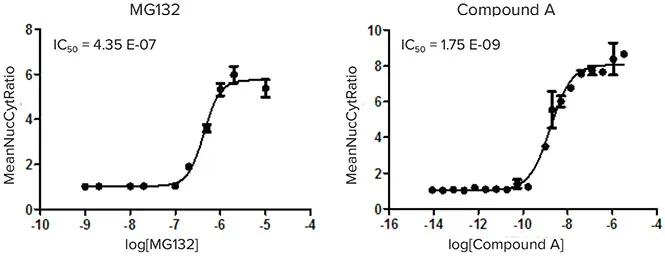
図5. 陽性コントロール化合物MG132(左)とヒット化合物A(右)の用量反応曲線。核コンパートメント:細胞質の平均強度比をプロットすることでIC₅₀値を決定。MG132陽性コントロールから算出されたZ’値が0.7を超えることでアッセイの堅牢性を示しています。
ハイスループットでトランスロケーションイベントを測定
本アッセイは、シグナル伝達経路を調節する化合物に応答したß-cateninのトランスロケーションを測定するもので、細胞内トランスロケーションイベントを検出するハイスループットアッセイの一例です。低倍率でも高品質な画像により、化合物活性の特徴付けに統計的に有意な測定結果が得られ、多数の化合物から活性化合物を明確に同定できました。細胞ベースのレポーター遺伝子アッセイとハイコンテントスクリーニングプラットフォームを組み合わせることで、タンパク質の細胞コンパートメント間トランスロケーションをスクリーニングするための完全なソリューションを提供します。
PDF版(英語)