Application Note 凍結CHO細胞を用いたムスカリンM3受容体アッセイの最適化:
FlexStation 3プレートリーダーによる評価
- 多用途アッセイにより、幅広い生物学的ターゲットへの応用が可能です
- 均一フォーマットによりプレートの取り扱いが簡素化され、スループットが向上します
- マルチチャネル液体分注機能により、アゴニストおよびアンタゴニスト試験のセットアップが容易になります
PDF版(英語)
はじめに
細胞ベースのアッセイは、しばしば困難で時間のかかる作業となります。この複雑なプロセスを効率化・簡素化するために、事前培養を必要とせずアッセイ可能な凍結細胞が、継続的に培養された細胞の代替手段として適しており、頻繁に使用されています。凍結細胞を用いることで、細胞培養の準備工程と機能評価を切り離すことができ、生物学的ばらつきの軽減、プレート間の一貫性およびデータの信頼性向上、アッセイスケジュールの柔軟性向上、さらには細胞培養コストの大幅な削減が可能となります。
FLIPR® Calcium 5 Assay Kit(図1)は、他の「洗浄不要」カルシウム試薬と比較して優れた性能を示し、さまざまな生物学的ターゲットに幅広く応用可能です。通常の洗浄ステップを省略することで、プレートの取り扱いが簡素化され、アッセイのスループットが向上するという重要な利点があります。さらに、アッセイ条件が最適でない場合でも、均一型アッセイを使用することでデータ品質の向上やウェル間のばらつきの低減が期待できます。
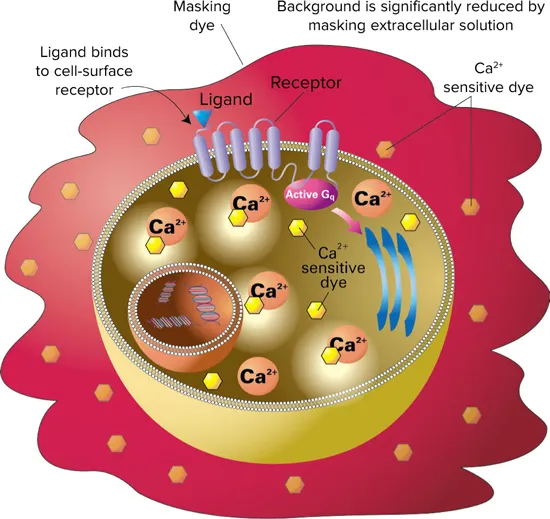
図1. FLIPR Calcium アッセイの原理 FLIPR Calcium アッセイキットには、カルシウム感受性色素が含まれており、インキュベーション中に細胞の細胞質内に取り込まれます。キットに含まれるマスキング色素は細胞外に留まり、バックグラウンド蛍光を遮断します。リガンドが受容体に結合すると、カルシウムが細胞質内に放出され、色素がカルシウムと結合して蛍光を発します。
FlexStation® 3 マルチモードマイクロプレートリーダーは、ディスペンサー型システムと比較して柔軟性が高く、試薬をソースプレートから測定プレートへ直接移送することで、試薬や消耗品の使用量を削減できます。細胞プレートの各カラムに対して個別の試薬および濃度を設定できるため、1回の実験でより多くのアッセイ条件を検討することが可能となり、アゴニストおよびアンタゴニスト試験の両方に理想的なシステムです。
本テクニカルノートでは、FlexStation 3 プレートリーダーを用いて、代表的なGq-GPCRアッセイにおいて、単波長および二波長の異なるCa²⁺インジケーターを比較し、均一型「洗浄不要」カルシウム試薬の利点を明らかにします。さらに、継続培養された細胞と、凍結試薬から調製された細胞(European Collection of Cell Cultures(ECACC)より提供される「アッセイレディ」細胞)との間で、アッセイ性能およびデータの信頼性を比較します。
材料
- FlexStation 3 マルチモードマイクロプレートリーダー(モレキュラーデバイスジャパン)
- AquaMax ® マイクロプレートウォッシャー(96ウェルセル洗浄ヘッド付き)(モレキュラーデバイス)
- ImageXpress ® Micro Widefield High Content Screening System(モレキュラーデバイス)
- FLIPR Calcium5 Assay Explorer Kit(モレキュラーデバイス、カタログ番号R8185)
- Fluo-4 AM(Invitrogen)
- Fura-2 AM(Invitrogen)
- DAPI 核酸染色 (Invitrogen)
- ヒトムスカリンM 3レセプターを発現する凍結保存 "Assay Ready "CHO細胞(CHRM3、ECACC)
- 水溶性プロベネシド(Invitrogen,)
- CHO細胞用培地 Hams F12: DMEM with 10% FBS and 1% pen/strep (Invitrogen,)
- カルシウムとマグネシウムを含むハンクス平衡塩類溶液 (HBSS)、20mM HEPES(Invitrogen,)
- セルプレート(黒壁透明底96ウェルCellBINDマイクロプ レート、コーニング)
- アセチルコリン、非選択的ムスカリン受容体作動薬(ACh、Sigma)
- p-フルオロヘキサヒドロシラジフェニドール塩酸塩、ムスカリン受容体アンタゴニスト(p-F-HHSiD、Sigma)
- メタノール(Sigma)
方法
細胞の取り扱いおよび播種方法
- ムスカリンM3受容体(CHRM3)を発現するCHO細胞を継続培養し、1ウェルあたり30,000細胞を200 µLの培地に播種しました。室温で30分間ベンチ上に静置した後、37°C、湿度95%、CO₂濃度5%の条件で一晩培養しました。
- 「アッセイ準備済み」凍結CHRM3細胞は、37°Cの水浴で迅速に解凍し、温めた培地10 mLに穏やかにピペッティングして加え、1000 rpmで5分間遠心しました。細胞を培地に再懸濁し、1ウェルあたり50,000細胞を200 µLの培地に播種しました。プレートは室温で30分間静置した後、37°C、湿度95%、CO₂濃度5%の条件で18時間培養しました。
- 凍結保存されたCHRM3細胞は、37°Cの水浴で迅速に解凍し、温めた培地10 mLに穏やかにピペッティングして加え、1000 rpmで5分間遠心しました。細胞は温めた培地10 mLに再懸濁され、CO₂インキュベーターに60分間戻されました。その後再度遠心し、FLIPR Calcium 5 アッセイ試薬に再懸濁して、1ウェルあたり75,000細胞を100 µLのローディングバッファーに播種しました。最後に、細胞プレートをブレーキなしで1000 rpmで再度遠心し、CO₂インキュベーターに45分間戻しました。
FLIPR Calcium 5 Assay Kitローディング
色素ローディングバッファーは、1バイアル分の色素を完全に溶解し、最終容量20 mLのHanks平衡塩溶液(HBSS)、20 mM HEPES、2.5 mMプロベネシド(pH 7.4に調整)で調製しました。細胞調製方法(1)および(2)で作製した細胞プレートをインキュベーターから取り出し、培地を除去した後、各ウェルに100 µLの色素ローディングバッファーを添加しました。色素を添加したプレートは、37°C、CO₂濃度5%の条件で45分間インキュベートし、その後室温で15分間平衡化させてからアッセイを実施しました。色素ローディング後のプレートは洗浄せず、初期アッセイ容量は1ウェルあたり100 µLでした。
Fluo-4 AMおよびFura-2 AMの色素ローディング
上記の方法(2)で調製した細胞は、培地を除去した後、Fluo-4 AMまたはFura-2 AM(2.5 µM、2.5 mMプロベネシド含有)を各ウェルに100 µL添加し、37°Cで45分間インキュベートしました。その後、AquaMax 4000 マイクロプレートウォッシャー(96ウェル用セル洗浄ヘッド装着)を用いて、HBSSバッファー(2.5 mMプロベネシド含有)で洗浄しました。洗浄プログラムは、複数の吸引および分注ステップで構成されています(表1参照)。
| ステップ | 動作 | 設定 |
|---|---|---|
| 1 | Aspirate | 吸引速度=5、下降速度=高速、滞留時間=2.0秒、プローブ高さ=1.0、2.0、または3.0 mm |
| 2 | Dispense | ディスペンス速度=1または2、容量=300 µL |
| 3 | Aspirate | 吸引(ステップ1と同じ) |
| 4 | Repeat | ステップ2を1回繰り返す |
| 5 | Dispense | ディスペンス速度=1または2、容量=300 µL |
| 6 | Aspirate | 下降速度=高速、滞留時間=2.0秒、プローブ高さ=4.5mm |
表1. CHRM3細胞を用いたカルシウムフラックスアッセイにおけるAquaMax 4000 マイクロプレートウォッシャーの設定パラメーター
ImageXpress Microシステムによる細胞数の確認
色素比較試験における細胞数およびコンフルエンスの検証のため、方法(2)で調製した細胞プレートにDAPI核酸染色を施し、ImageXpress Micro ハイコンテントスクリーニングシステムでイメージングを行いました。簡単に説明すると、細胞はさまざまな密度で調製され、37°C、湿度95%、CO₂濃度5%の条件で18時間インキュベートされました。培地を除去し、各ウェルに100 µLの氷冷メタノールを添加しました。5分後にメタノールを除去し、各ウェルに100 µLのDAPI溶液(300 nM)を添加して5分間インキュベートし、その後HBSSで3回洗浄しました。細胞単層は4倍対物レンズを用いてウェル全体を撮像し、MetaXpress®ソフトウェアの「核カウント」アプリケーションモジュールを使用して、ウェルごとの総細胞数を算出しました。
細胞最適化アッセイ
3種類の細胞取り扱い方法を比較するため、アセチルコリン(ACh)によるアゴニスト応答曲線およびp-F-HHSiDによるアンタゴニスト阻害曲線を定性的および定量的に評価しました。色素インキュベーションおよび温度平衡化後、カルシウム動員アッセイは室温で実施されました。アセチルコリン(ACh)の希釈系列は、HBSSバッファー中で最終濃度の3倍濃度(アッセイ濃度:0.03 nM~300 nM)で調製され、96ウェルポリプロピレンプレートに分注し、各ウェルに50 µLずつ添加して細胞内Ca²⁺の放出を刺激しました。
アンタゴニスト試験では、p-F-HHSiDを3倍濃度で調製し、ACh(EC₈₀)の4倍濃度を添加する15分前にオフラインで添加しました。
蛍光測定は、化合物添加の前後および添加中の90秒間にわたって行いました。
カルシウムインジケーター比較アッセイ
カルシウムフラックスは、FlexStation 3 プレートリーダーの「Flex」読み取りモードを使用して測定しました。FLIPR Calcium 5 Assay Kit、Fluo-4 AM、Fura-2 AMで色素をローディングした細胞に対し、FlexStation 3 プレートリーダーの統合型8チャネルピペッターを用いて、アセチルコリン(ACh)を5倍希釈系列(20 pM~8 µM)で添加しました。蛍光測定は、化合物添加の前後および添加中の90秒間にわたり、最適化されたパラメーター(表2参照)で実施しました。
| パラメーター | 設定 | ||
|---|---|---|---|
| Calcium 5 | Fluo-4 AM | Fura-2 AM | |
| 読み取りタイプ | Flex | ||
| 読み取りモード | 蛍光、ボトムリード | ||
| 励起波長 | 485 nm | 485 nm | 340/380 nm |
| 発光波長 | 525 nm | 525 nm | 510 nm |
| カットオフ | 515 nm | 515 nm | なし |
| 稼働時間 | 90秒 | ||
| インターバル | 1.6 秒 | 1.6 秒 | 3.5秒 |
| 化合物の添加 | |||
| 初期容量 | 100 µL | ||
| ピペットの高さ | 65 µL | ||
| 容量 | 50 µL | ||
| レート | 4 (64 µL/s) | ||
| 時点 | 20秒 |
表2. FlexStation 3 プレートリーダーを用いたCHRM3細胞のカルシウム色素比較アッセイにおけるSoftMax Proソフトウェアの最適設定
アンタゴニスト試験における操作。p-F-HHSiDは、対象ウェルに手動で添加され、FlexStation 3 プレートリーダーにプレートを設置する15分前に平衡化されました。その後、装置内蔵の液体分注システムを使用して、ACh(EC₈₀濃度)を各ウェルに50 µL分注し、蛍光変化をリアルタイムでモニタリングしました。
データ解析
応答は、FLIPR Calcium 5 アッセイキットまたはFluo-4 AMの場合はピーク蛍光強度、Fura-2 AMの場合は最大の340/380 nm比として測定されました。比較を容易にするため、データはベースラインに対する%応答として正規化され、平均値 ± 標準誤差(s.e.m.)で表記されました(n ≥ 4)。
濃度-効果曲線の各データセットは、以下の形式の4パラメータロジスティックモデルにフィッティングされました:
$$E = \beta + \frac{(\alpha - \beta) [A]^n}{[EC_{50}]^n + [A]^n}$$
ここで、α、β、EC₅₀およびnはそれぞれ、上限漸近値、下限漸近値、位置パラメーター(EC₅₀/IC₅₀)、およびスロープパラメーターを示します。すべてのカーブフィッティング処理は、SoftMax Pro 6 ソフトウェアを使用して実施されました。
Z´因子は、以下の式を用いて算出されました:
$$Z' = 1 - \frac{(3\sigma_{c^{+}} + 3\sigma_{c^{-}})}{|\mu_{c^{+}} - \mu_{c^{-}}|}$$
σ₍c⁺₎はポジティブコントロールの標準偏差、σ₍c⁻₎はネガティブコントロールの標準偏差を示します。|μ₍c⁺₎ − μ₍c⁻₎|は、ポジティブコントロールの平均値とネガティブコントロールの平均値の差の絶対値を表します。Z´因子が0.5を超える場合、ポジティブコントロールとネガティブコントロールの間に十分な分離帯があることを示し、アッセイの堅牢性が高いと判断されます。*1
結果
細胞最適化アッセイ
FLIPR Calcium 5 Assay Kitで色素をローディングしたCHRM3細胞 *2は、3種類の細胞調製方法すべてにおいて、ACh添加に対して強い蛍光応答を示しました(図2)。
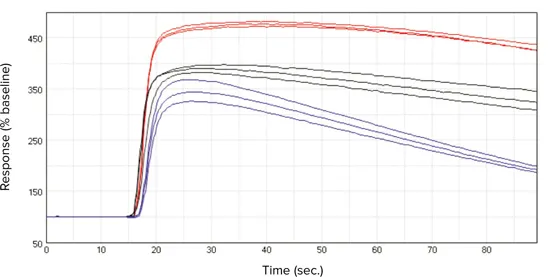
図2. キネティック・トレース
FLIPR Calcium 5 Assay Kitで色素をローディングしたCHRM3細胞に300 nMのAChを添加した際の代表的なキネティックトレース。SoftMax Pro 6 ソフトウェアから出力されたデータで、FlexStation 3 プレートリーダーで取得。細胞条件は、(●)継続培養細胞、(●)解凍後18時間培養した凍結細胞、(●)解凍直後の凍結細胞。Y軸はベースラインに対する%応答、X軸は時間(秒)を示します。
AChのEC₅₀値は、3つの細胞調製方法間で0.5 log単位以内の範囲に収まりました(表3)。ただし、凍結細胞を直接使用した場合には、EC₅₀値に有意な右方シフト(P < 0.05)が認められました(図3)。同様に、p-F-HHSiDのIC₅₀推定値は、3つの細胞調製方法間で類似していました。Z´因子の推定値は、継続培養細胞および解凍後18時間培養した凍結細胞で高く、凍結細胞を直接使用した場合よりも良好でした。
| 培養細胞 | 18時間後の凍結細胞 | 凍結細胞 | |||||||
|---|---|---|---|---|---|---|---|---|---|
|
EC50 /IC50 |
% R/B | Z’ |
EC50 /IC50 |
% R/B | Z’ |
EC50 /IC50 |
% R/B | Z’ | |
| ACh |
1.9 x 10-9 M |
378 | 0.61 |
2.5 x 10-9 M |
501 | 0.78 |
6.3 x 10-9 M |
352 | 0.41 |
|
p -F-HHSiD |
3.6 x 10-8 M |
341 | 0.57 |
3.7 x 10-8 M |
450 | 0.81 |
4.9 x 10-9 M |
286 | 0.24 |
表3. FLIPR Calcium 5 Assay Kitで色素をローディングしたCHRM3細胞における3種類の細胞取り扱い条件の比較結果
※アゴニストデータのZ´因子は、EC₈₀応答を用いて算出しました。ベースラインに対する%応答(% R/B)は、ベースラインを100%応答としてピーク応答を算出した値です。
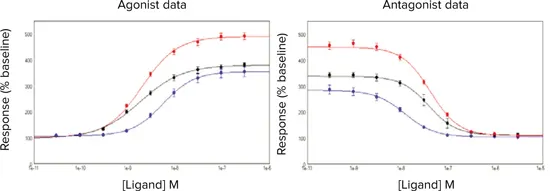
図3. 活性化/阻害曲線
AChの活性化/阻害曲線±p
FLIPR Calcium 5 Assay Kitで色素をローディングしたCHRM3細胞におけるACh ± p-F-HHSiDの活性化/阻害曲線。細胞条件は、(●)継続培養細胞、(●)解凍後18時間培養した凍結細胞、(●)解凍直後の凍結細胞。
これらの初期検討において、EC₅₀推定値、シグナル強度、Z´因子の改善、細胞調製の容易さ、消耗品コストの低減などを総合的に評価した結果、以降のすべての実験は「解凍後18時間培養した凍結細胞(方法2)」を用いて実施しました。
ImageXpress Microシステムによる細胞数の確認
細胞数およびコンフルエンスを実証的に確認するため、細胞調製方法(2)に従って2枚の代表的な細胞プレートを作製しました。翌日、DAPI核酸染色を施し、ImageXpress Micro ハイコンテントスクリーニングシステムでイメージングを行いました(図4)。

図4. 細胞密度
ImageXpress Micro ハイコンテントスクリーニングシステムで取得した代表的な細胞密度画像。各代表ウェルの上部には、元の播種密度が数値で示されています。
この一連の実験において、安定した単層を形成する最適な細胞密度は、1ウェルあたり50,000細胞であると判断されました(表4)。この細胞密度は、以降のすべての実験に使用されました。
| 18時間後の細胞数 | (ウェルあたりの平均細胞数 |
|---|---|
| 80,000 | 71,935 |
| 70,000 | 64,496 |
| 60,000 | 58,209 |
| 50,000 | 53,374 |
| 40,000 | 44,002 |
| 30,000 | 34,348 |
| 20,000 | 24,515 |
| 10,000 | 14,482 |
表4. DAPI染色したCHRM3細胞による細胞密度の結果
データはMetaXpressソフトウェアの「核カウント」アプリケーションモジュールを用いて解析されました。
カルシウムインジケータ比較アッセイ
AChは、FLIPR Calcium 5 アッセイキット、Fura-2 AM、Fluo-4 AMで色素をローディングしたCHRM3細胞において、濃度依存的な細胞内Ca²⁺の増加を引き起こしました(図5)。
一元配置分散分析(ANOVA)の結果、Fluo-4 AMおよびFura-2 AMのEC₅₀推定値には有意差が認められませんでした(P値=0.92)。
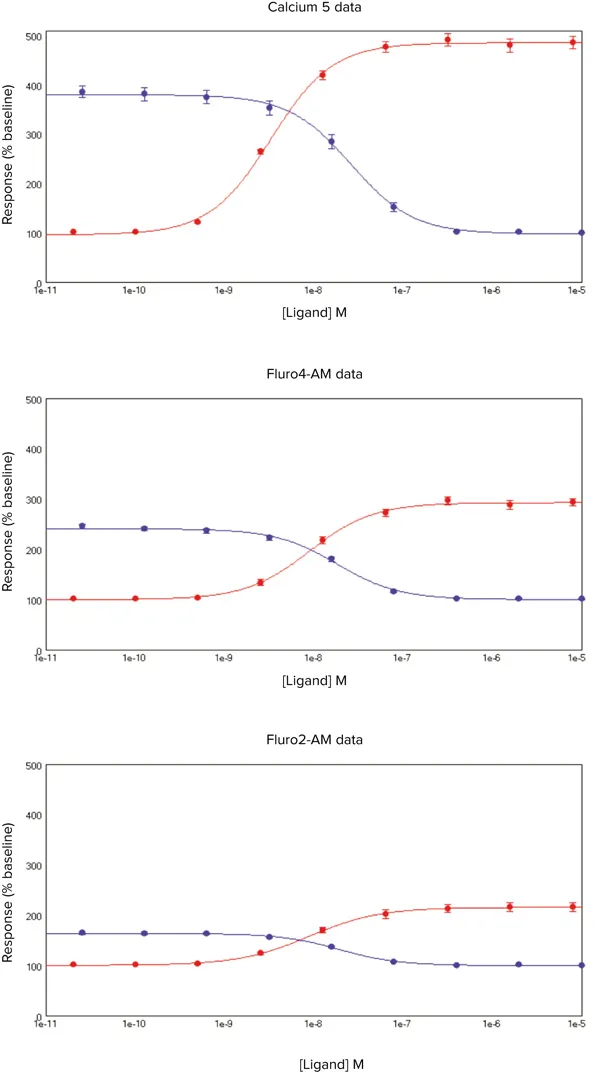
図5. Calcium 5 Assay Kitのデータ
SoftMax Pro 6 ソフトウェアによるプロット。
X軸はACh(●)またはp-F-HHSiD(●)の濃度、Y軸はシグナル変化率(%)。FLIPR Calcium 5 Assay Kit、Fluo-4 AM、Fura-2 AMで色素をローディングしたCHRM3細胞のデータ。平均値 ± 標準誤差(s.e.m.)で表示。
一方、FLIPR Calcium 5 アッセイキットでは、EC₅₀値の有意な左方シフト(P < 0.05)、高いZ´因子、ベースラインに対する応答値の増加が認められ、この「洗浄不要」アプローチがより最適であることが示唆されました。
比較として、p-F-HHSiDのデータでは、算出されたpIC₅₀値に有意な差は認められず、アンタゴニストの結合はアッセイ調製方法によって大きく影響されないことが示されました(表5)。
スクリーニング係数ウィンドウ(Z´因子)は、シグナルのダイナミックレンジおよびアッセイのデータ変動を反映する指標であり、バッファー添加(ネガティブコントロール)およびAChのEC₈₀濃度(アゴニストのポジティブコントロール)を用いて算出されました。3種類の色素すべてでZ´因子は0.5を超えており(表5)、ポジティブコントロールとネガティブコントロールの間に十分な分離帯があり、再現性の高い高品質なアッセイであることが示されました。ただし、FLIPR Calcium 5 Assay Kitのデータは、他の2種類のカルシウムインジケーターと比較して一貫して高いZ´因子および大きな応答(% R/B)を示しました。
| FLIPR Calcium 5 Assay Kit | Fluo-4 AM | Fura-2 AM | |||||||
|---|---|---|---|---|---|---|---|---|---|
|
EC50 /IC50 |
% R/B | Z’ |
EC50 /IC50 |
% R/B | Z’ |
EC50 /IC50 |
% R/B | Z’ | |
| Acetylcholine |
3.1 x 10-9 M |
485 |
0.81 |
7.9 x 10-9 M |
294 | 0.58 |
3.7 x 10-9 M |
215 | 0.63 |
|
p -F-HHSiD |
2.3 x 10-8 M |
377 | 0.87 |
2.0 x 10-8 M |
290 | 0.72 |
2.1 x 10-9 M |
174 | 0.78 |
表5. FlexStation 3 プレートリーダーによる、3種類のカルシウムインジケーターで色素をローディングしたCHRM3細胞の結果(n ≥ 6)
結論
FlexStation 3 プレートリーダーとFLIPR Calcium 5 Assay Kitの組み合わせは、ムスカリンM3受容体を発現する「アッセイ準備済み」凍結CHO細胞における細胞内Ca²⁺変化の測定に最適であることが示されました。デュアルモノクロメーターにより、励起波長および蛍光波長の最適な選択が可能となり、単波長および二波長比指標の両方に対応できます。
凍結細胞がアッセイ試薬として有効な選択肢として登場したことで、アッセイ開発およびスクリーニングプロセスがさらに効率化されました。本研究では、継続培養細胞と比較して凍結細胞のデータ品質の利点を実証しました。凍結細胞を使用することで、消耗品、培地、人的リソース(FTE)の大幅な節約も可能です。
従来のFlexStationプレートリーダーで手動洗浄を行っていた類似実験と比較すると、AquaMax 4000 マイクロプレートウォッシャーの使用により、アッセイ品質の向上が期待されます。
さらに、FlexStation 3 プレートリーダーを用いた簡便なアッセイ最適化と、FLIPR Calcium 5 Assay Kitのような「洗浄不要」試薬によるデータ信頼性の向上も示されました。
参考文献
- Zhang, J-H., Thomas, T.D.Y. and Oldenburg, K. R. (1999). A simple statistical parameter for use in evaluation and validation of high throughput screening assays. J. Biomol. Screen., 4, 67–73.
- Schucht, R., Lydford, S., Andzinski, L., Zauers, J., Cooper, J., Hauser, H., Wirth, D. and May, T. (2011). Rapid Establishment of G-ProteinCoupled Receptor–Expressing Cell Lines by Site-Specific Integration. J Biomol Screen., 16, 323-331.
FlexStation 3マルチモードマイクロプレートリーダーの詳細はこちら>>
PDF版(英語)