Application Note よりin vivoに近いデータを生成しながら、細胞毒性効果を予測
- 2Dまたは3Dアッセイ用の再現性と信頼性の高いデータでリアルタイムの細胞毒性効果を自動化
- ウェル深度可変のインフォーカス画像を生成
- より適切な濃度の反応閾値の予測
- グラジエント薬物曝露のリアルタイム結果で定量可能なデータを作成
PDF版(英語)
はじめに
細胞ベースアッセイにおける次のステップは、化合物治療による適応的メカニズム対毒性メカニズムをより正確に評価するために、臓器や生体系の複雑性を再現することです。動的な暴露シナリオでは、endpoint dose-response curveから外挿するよりも、反応の濃度閾値をより正確に予測することができます。
SciFlow™ 1000 流体培養システムは、自動リキッドハンドリングおよびイメージングシステムと互換性のあるSBS標準フォーマットのマルチウェルマイクロ流路プラットフォームです。SciFlow 1000 システム全体は、外部ポンプや接続チューブを必要とせずに細胞ベースアッセイへの流体運動とグラジエント化合物曝露を可能にする8つの同一チャンネルを含む96ウェルフォーマットに封じ込められます(図1)。ImageXpress®Microハイコンテントイメージングシステムを使用することで、チャンネル全体の細胞反応を動的に画像化・測定し、z-heightの変化に合わせて自動的に調整することができました。
ハイコンテントイメージングを用いたこのシステムの価値を実証するため、DNA結合試薬CellTox™ Greenを用いて、代謝能の高い肝細胞モデルに対するアフラトキシンBの経時的影響を評価しました。
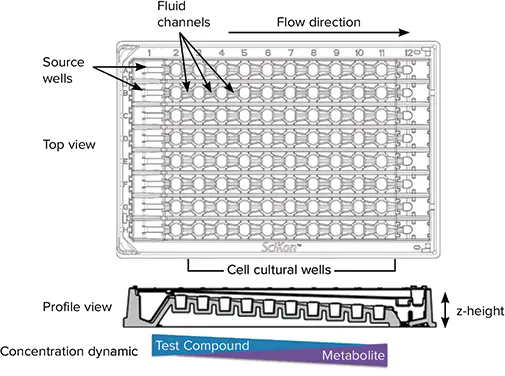
図 1. SciFlow 1000 システムの特徴。SciFlow のトップビューとプロファイルビューは、フルイディクスとマルチウェルの主な特徴を示しています。プロファイル図では、各ウェルのZ-heightの違いにご注意。ソースウェル(カラム1)に試験薬液を塗布し、後続のウェルに連続的に曝露すると、化学薬液濃度が低下する勾配が生じ、リンクされたウェルの直線配列全体で代謝物と細胞反応が同時に増加します。
使用材料
- SciFlow 1000 流動培養システム (SciKon)
- HepG2細胞 (ATCC)
- 培地 10%FBS添加DMEM、1X Glutamax、1X Pen/Strep
- CellTox™ Green細胞毒性アッセイ (Promega)
- Hoechst DNA Dye (Sigma)
- アフラトキシンB (Sigma)
- フルオレセイン塩 (Sigma)
- ImageXpress Micro XLS ハイコンテントイメージングシステム(モレキュラーデバイス)
ImageXpress Micro XLS を用いた Z-height focusの方法
各ウェルの z-heightを最適化するために、HepG2 細胞を SciFlow 1000 システムにプレーティングし、Hoechst による核 DNA 染色で分析しました。SciFlow 1000 システムのz-height 調整を表1に示し、7列目はイメージング中のイメージオートフォーカスの最適化に使用したシステム中間点またはゼロ基準点です。
SciFlow 1000システムのz-height調整
カラム34567891011
ミクロン+ 2000+ 1500+ 1000+ 500 0 - 500 - 1000- 1500 - 2000
表 1. ImageXpress Micro XLS を使用した SciFlow 1000 システムの Z- Heights
実験
HepG2細胞のアフラトキシンB処理に関する実験デザイン(図3)の実行方法を、私達のプロセスワークフロー(図2)に概説します。HepG2細胞を50μL培地にプレーティングしました。接着後、培地を除去し、1:2000希釈のCellTox Greenと0.5 µg/mlのHoechstを封じ込めた100 µL/ウェルの新しい培地を加えました。その後、CellTox Green を封じ込めた培地 400 µL をソースウエルに添加しました。プレーティングを30 分間インキュベートし、流路を接続させました。完全に接続されたら、100 µL の試験化合物、ビヒクルコントロール、または 1 µM フルオレセイン(流体トレーサーコントロール)をソースウェルに添加しました。複数日にわたって流体の流れを維持するため、カラム11のウェルから100µLを手動で抜き取り、新しい薬剤、ビヒクル、またはフルオレセイン標準液を1日3回、ソースウェルに添加しました。この結果、4日間にわたって培地が完全に交換される一方、各群で濃度の増加する薬剤が常に注入されることになります。Hoechstシグナル(全細胞)とCellTox Greenシグナル(死細胞)をImageXpress Micro XLSでモニターしました。

図2. メソッドのワークフロー。
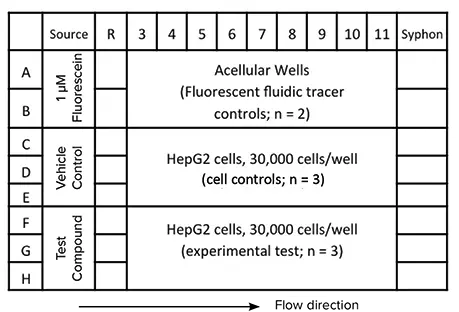
図 3. SciFlow 1000 システム 1 台の実験レイアウト例。細胞の播種と接着(50 µL)はカラム 3 ~ 11 で行います。その後、ウェル容量を 100 µL に増やし、ウェル間の流体連通を可能にします。最後に、試験化合物をカラム 1 のソースウェルに添加します。
フルオレセインを用いた流体トレーサー
フルオレセインは標準流体トレーサーとして使用され、被験物質の濃度をいつでも測定することができます。これは、フルオレセイントレーサーの蛍光をモニターし、所定のstandard curve(0.001 µMから1 µM)に基づいて濃度を計算することにより行われます。standard curveは、培地にフルオレセインを溶解した個々のウェルから作成し、ImageXpress Micro XLSを用いてFITC(フルオレセインイソチオシアネート)イメージングを行いました。フロー実験中、ソースウェル(カラム1)のフルオレセイン開始濃度は 1 µM、AFbは10 µMでした(5 µMは100%致死量とみなされます)。AFb濃度を外挿するため、各ウェル中のフルオレセイン量に開始AFb濃度を掛け合わせ、経時的なビヒクルまたは試験化合物の対応濃度を求めました(図4)。
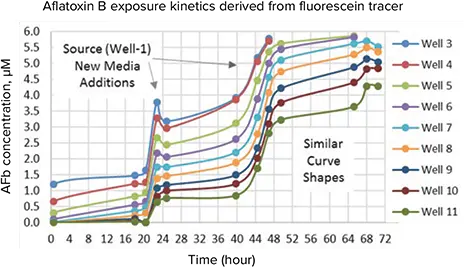
図 4. このグラフは、SciFlow 1000 システムの各カラムにおける 72 時間の化合物/毒物の露光時間勾配を表しています。AFb 濃度データはフルオレセイン流体トレーサーから外挿したものです。値は 3 レプリケートの平均値です。
結果
フロー開始後、4日間にわたって画像を取得し、生細胞数と死細胞数を分析しました。図5Aは、経時的なコントロール細胞の生存率を示します。図5BはアフラトキシンB実験の細胞生存率を示します。1チャンネル(カラム3-11)を0.0~91.8時間の間の16の異なる時点で評価しました。各ウェルの値は、実際には3反復の平均値です。表中のパーセンテージは細胞生存能の変化を表します。
図5Bは、経時的に生存細胞の割合が減少していることを示し、これはヒートマップでも視覚的に確認できます。
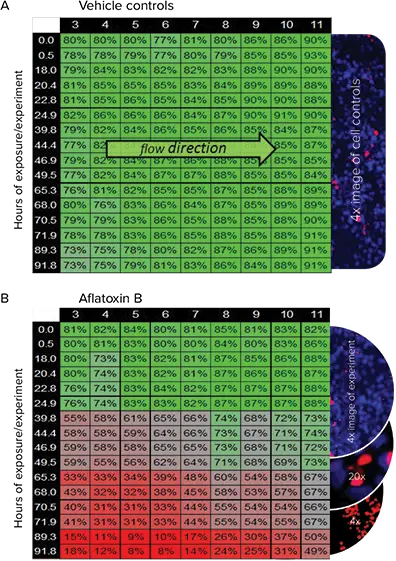
図5. 生存細胞の割合による細胞毒性のマッピング。表データはSciFlow 1000 システムの行全体の細胞生存率を示します。表の列は SciFlow 1000 システムの対応する列(3-11)を表します。表の行は実験が測定された時点です。値は4倍画像から作成しました。(A) この表は、経時的な生存コントロールセルのパーセンテージを示します。値はC、D、Eの行の平均値です。(B)この表はアフラトキシンBの細胞生存率を示します。値はF、G、H行の平均。イメージング:青は全細胞のHoechst核染色です。赤はCellTox Greenで染色した非生存細胞です。
結論
ImageXpress Microハイコンテントイメージングシステムは、SciFlow 1000流動培養システムを用いて、リアルタイムの流体の流れ、直接的な細胞培養反応、および細胞反応のダイナミックなコンパートメント間シグナリングを効果的にモニターすることができます。ロバスト性の高いMetaXpress®ソフトウェアと組み合わせることで、濃度閾値の迅速な予測や、in vivoモデルを反映した定量可能なデータを生成するために、勾配薬物曝露のリアルタイム結果を迅速に取得し、解析することができました。
PDF版(英語)