Application Note Axon pCLAMPとMetaMorphソフトウェアによる
電気生理学とイメージング研究の同期化
PDF版(英語)
Ed Rader and Jeffrey Tang , モレキュラーデバイス, 1311 Orleans Drive, Sunnyvale, CA 94089.
はじめに
ライブセル研究では、細胞内プロセスを記述するために、補完的なデータを同時に取得する必要性が高まっています。イメージングと電気生理学的手法の両方による同時記録は、両タイプのデータ間に貴重な相関性をもたらし、様々な細胞反応を調べるために広く用いられてきました。しかし、研究室によっては、実験ワークフローの中で両方のプログラムを同期させることは困難な作業です。モレキュラーデバイスのAxon™ pCLAMP™ Electrophysiology Data Acquisition and Analysis SoftwareとMetaMorph® Microscopy Automation and Image Analysis Softwareは、それぞれ電気生理学と画像解析のための洗練された強力なプログラムです。本ハイライトの目的は、pCLAMPとMetaMorphの両ソフトウェアプログラムを同期させ、高解像度の電気生理学的データとイメージングデータを取得するための簡単なソリューションを提供することです。
方法
pCLAMPとMetaMorphソフトウェアの接続
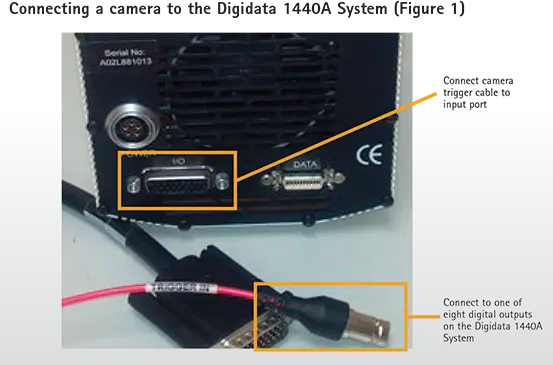
pCLAMPソフトウェアで駆動するAxon™ Digidata® 1440Aデータ収集システムは、フロントパネルに8つのデジタル出力を備えています。カメラの外部トリガーケーブルをこれら8つのデジタル出力のいずれかに接続し、残りのケーブルをCCDカメラのトリガー入力ポートに接続します(図1)。使用するカメラシステムによっては、ケーブルと入力ポートの形状が図1と異なる場合があります。
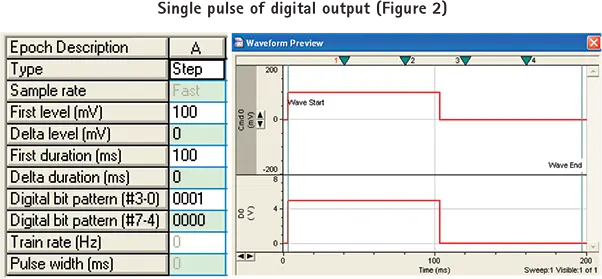
pCLAMPソフトウェアでのシングルパルスデジタル出力の設定
デジタル出力はアナログ出力と同様に pCLAMP ソフトウエアの Clampex モジュールで制御します。デジタル出力をプログラムする最も汎用的な方法は、エピソード刺激(Episodic Stimulation)取得モードを使用することです。この収集モードを設定するには
ステップ 1. Clampex 10 ModuleでEdit Protocolメニューを選択し、Waveformタブ(以前のバージョンのClampex ModuleではWave #0/Wave #1タブ)を開きます。
ステップ2. 右上の "Digital Outputs "にチェックを入れます。波形表の "Digital bit pattern "の2行が有効になり、Digidata 1440A System with Clampex 10 Moduleの8つのデジタル出力に対応します。Clampexモジュールの以前のバージョンでは、4つのデジタル出力(0から3)しか制御できないため、1つの行だけが有効になっています。
ステップ3. デジタルビットパターン "行をプログラムします。デジタルビットパターン "の値は、エポック期間中のデジタル出力の状態に対応します。ビットパターンの各桁(0または1の値のみ)は、Digidata 1440Aシステムインターフェースのデジタル出力の1つに直接対応します。0 "はパルスが発生しないことを意味し、"1 "は5Vパルスが発生することを意味します。ビット "は逆順に表示され、例えば#3-0となります。図 2 のセットアップ例では、デジタル・ビット・パターンは "0001 "に設定されており、100ms の 100mV 電圧ステップが細胞に印加されている間、5V の TLL パルスがデジタル出力#0 から送出され、カメラをトリガーします。カメラへのデジタル出力は細胞へのアナログ出力と同期しています。
pCLAMPソフトウェアからパルスを1回送信した後、MetaMorphソフトウェアで画像を取得
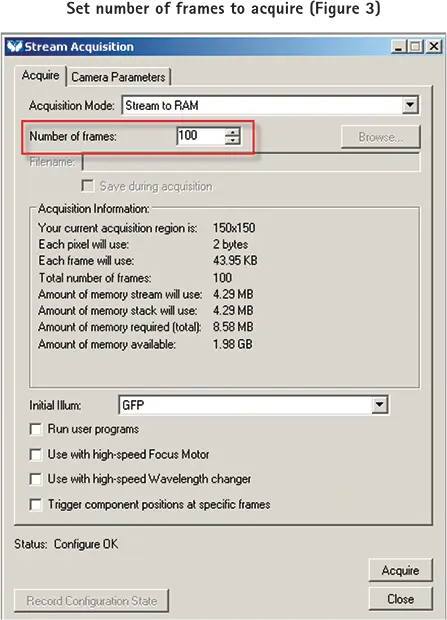
pCLAMP ソフトウエアから1パルスを送信した後、MetaMorph ソフトウエアで設定した枚数の画像を取得するように設定するには、まず Acquire ダイアログを開き、サンプルの希望する強度レベルに必要な露光時間とゲイン設定を行います。次にStream Acquisitionダイアログを開き、ダイアログのAcquireタブで取得するフレーム数を設定します(図3)。
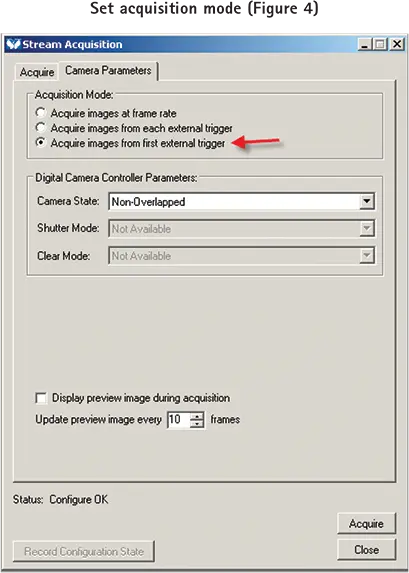
Camera Parametersタブを選択し、Acquisitionモードを "Acquire images from the first external trigger "に設定します(図4)。
pCLAMP ソフトウエアでの複数パルス(トレイン)デジタル出力設定
デジタル出力のトレインパルスを生成するには、まずデジタルビットパターンを "000*"に設定します。
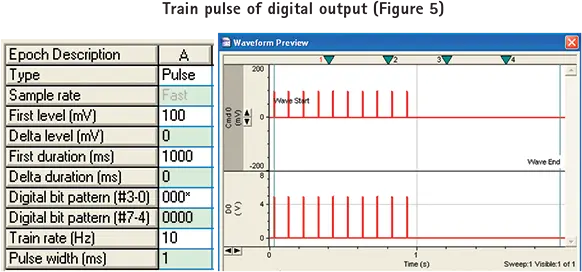
pCLAMPソフトウェアで設定したトレインパルスレートでMetaMorphソフトウェアで画像を取得
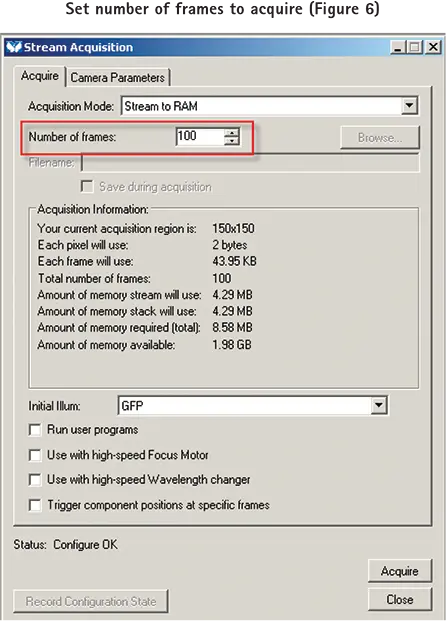
pCLAMP ソフトウェアで設定したトレインパルスレートで、MetaMorph ソフトウェアで設定した枚数の画像を取得するには、まず Acquire ダイアログを開き、サンプルの希望する強度レベルに必要な露光時間とゲイン設定を行います。次に Stream ダイアログの Acquire タブで取得するフレーム数を設定します(図6)。
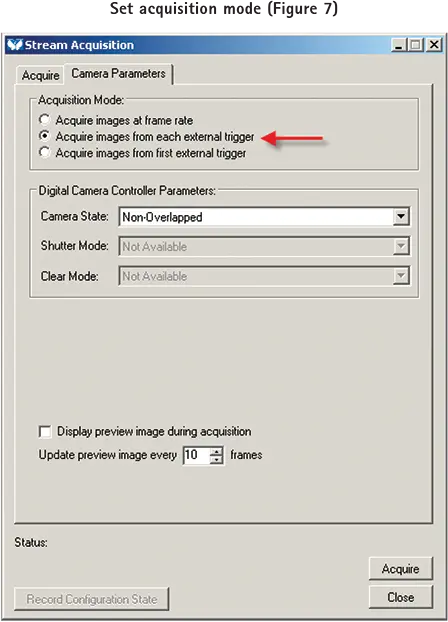
Camera Parameters(カメラパラメータ)タブを選択し、 Acquisition mode(画像取得モード)を "Acquire images from each external trigger(外部トリガごとに画像を取得する)"に設定します(図7)。
各パルスを受信するごとに新しい画像が取得されます。取り込みレートがパルスレート(pCLAMP ソフトウエアの Train Rate)と一致することを保証するために、パルスレートはカメラの露光時間または読出し時間、またはカメラの露光時間と読出し時間の合計よりも長く設定する必要があります。
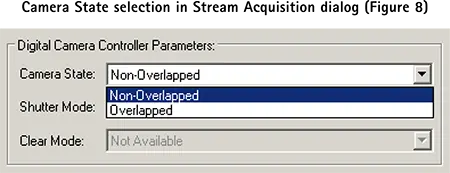
カメラが前の画像取り込みを終了する前に pCLAMP ソフトウエアから次のトレインパルスを受信した場合、そのパルスは無視され、次のパルスで画像取り込みが行われます。Streamダイアログで指定したフレーム数に達するまで、トレインレートで撮影を続けます。
結果
pCLAMPとMetaMorphソフトウェアの研究結果
最近の研究で、シカゴ大学のSteve Goldstein博士らは、小さなユビキチン様修飾タンパク質(SUMOs)の修飾が、カリウムKv2.1チャネルの制御を通じて、ラット海馬ニューロンの膜興奮性を変化させることを実証しました(Plant et al.) 本研究では、電気生理学的アプローチとイメージング・アプローチの両方を用いました。まず、野生型SUMO1101の細胞内投与に対する培養海馬ニューロンの電気生理学的反応を調べました。神経細胞の膜興奮性は、電流クランプ条件下で静止膜電位と誘発活動電位の発火率を測定することによってアクセスしました。Kv2.1電流は、Kv2.1カリウムチャネルを一過性に発現するCHO細胞を用いて、全細胞電圧クランプモードでアクセスしました。内在性SUMO2/3によるネイティブKv2.1チャネルのスモイル化は、蛍光共鳴エネルギー移動(FRET)顕微鏡によって、細胞体と近位樹状突起の特徴的なKv2.1クラスター内外で観察されました。
図9Aでは、初代培養ラット海馬ニューロンの静止膜電位と誘発活動電位を、全細胞電流クランプモードで記録しました。組換えSUMO1101の細胞内投与は、濃度依存的に静止膜電位と誘発活動電位の発火率を上昇させました(図9B)。
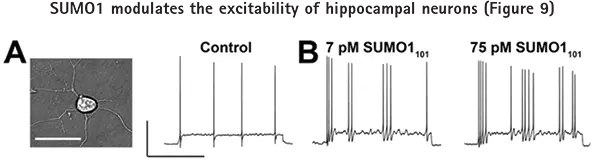
ピペットを介してSUMO1101に曝露し、全細胞モードで静止膜電位と誘発活動電位の発火率(10pAの電流を2秒間注入)を評価したラット海馬ニューロン。Aのバーは50mV、1秒。A: 神経細胞の顕微鏡写真(左)。ベースライン条件下での誘発活動電位(右)。B: 活動電位発火はピペット内の7 pM SUMO1101で頻度が増加し(左)、75 pM SUMO1101でさらに増加しました(右)。全細胞電流クランプ記録は、Axon pCLAMPソフトウェアとAxon™ Axopatch™ 200B Amplifierを用いて行いました。©Plant et al. 原著はThe Journal of General Physiologyに掲載。137:441-454.
Kv2.1チャネルがスモイル化による膜興奮性の上昇に寄与しているかどうかを調べるため、Kv2.1カリウムチャネルを一過性に発現させたCHO細胞にSUMO1101を細胞内投与した際のKv2.1カリウム電流を全細胞電圧クランプモードでアクセスしました。図10において、Kv2.1カリウム電流は、細胞内SUMO1101塗布によって減少しましたが、脱スモイル化に関与する酵素であるSentrin-specfic protease 1(SENP1)によって増大しました。
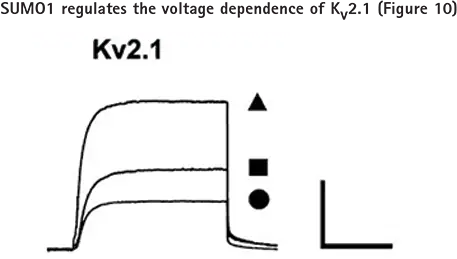
CHO細胞の全細胞モードで、コントロール条件下(■;n=15細胞)、75 pM SUMO1101添加(-;n=12細胞)、またはピペット内に250 pM SENP1添加(▲;n=12細胞)で、-80 mVから50 mVまで500 msのテストパルスを10秒ごとに加えてKv2.1チャネルを調べました。バーは2 nA、200 ms。全細胞ボルテージクランプ記録は、Axon pCLAMPソフトウェアとAxon Axopatch 200B Amplifierを用いて行いました。
pCLAMPソフトウェアで設定したパルシング中のパッチされた細胞の生理学的および形態学的変化のイメージングに加えて、MetaMorphソフトウェアを使用すると、コロカライゼーションによるタンパク質間相互作用のような細胞内の他の情報をキャプチャすることができます(図11)。
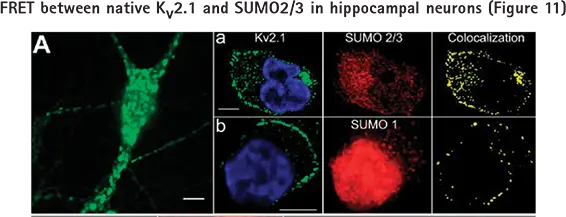
培養ラット海馬ニューロンを免疫染色で調べました。すべてのパネルのバーは10μm。A:Kv2.1のクラスターとドメイン外を示す広視野写真。パネルa: 薄切片顕微鏡によるKv2.1とSUMO2/3の密集した共局在(0.48μmスライス)。左:Kv2.1(緑)と核(青)染色。中央: SUMO2/3。右: Kv2.1とSUMO2/3の共局在。パネルb:Kv2.1とSUMO1の画像化、処理、およびパネルaと同様の共局在化。
参考文献
L. D. Plant, E. J. Dowdell, I. S. Dementieva, J. D. Marks, S. A. Goldstein. SUMO modification of cell surface Kv2.1 potassium channels regulates the activity of rat hippocampal neurons. J Gen Physiol Vol. 137 No.5 441-454, 2011.
顕微鏡用画像解析ソフトウェアMetaMorphの販売終了のご案内>>
PDF版(英語)