Application Note T細胞刺激による大腸がんオルガノイドの
形態変化をAIで解析
- T細胞ワークフローにおけるタイムラプス・ハイコンテントイメージングの自動化と実装の成功
- 多様な大腸がんオルガノイドの形態に対応したカスタマイズ済みセグメンテーションモデルの活用
- 大腸がんオルガノイドを個々の形態的特徴に基づいて分類
PDF版(英語)
はじめに
Zhisong Tong | リサーチサイエンティスト | モレキュラーデバイス
免疫療法は、がん治療の一手法として近年ますます注目を集めています。キメラ抗原受容体(CAR)T細胞療法は、T細胞を遺伝子改変することでがん細胞を標的として破壊できるようにし、免疫系を活性化させる治療アプローチです。血液がんに対する免疫療法では多くの成功例が報告されていますが、固形がんへの応用には依然として課題が残されています。その障壁の一つが、固形がんの腫瘍微小環境(TME)に内在する免疫抑制性サイトカインの存在であり、これがT細胞の腫瘍殺傷能を制限しています。したがって、TMEはがん治療への応答において重要な役割を果たしており、TMEの理解はCAR T細胞の有効性を高めるために不可欠です。
3D患者由来オルガノイド(PDO)を用いる利点は、従来の2D単層培養では再現できないTME内の物理的・化学的刺激をより忠実に模倣できる点にあります。研究により、PDOは元の腫瘍と類似した薬剤応答を示すことが明らかになっており、治療効果の向上に向けた有用なモデルであることが示唆されています。このように、PDOは固有の不均一性、長期安定性、ハイスループットスクリーニングへの適用性、腫瘍特性の再現性といった点で、2Dモデルに比べて優れた前臨床モデルシステムといえます。
しかしながら、PDOの使用には、高コストかつ労力を要する培養・維持管理といった課題があり、創薬研究における広範な応用には制限があります。これらの課題に対応するため、アッセイ対応オルガノイドを大規模に増殖可能なセミオートメーション型バイオリアクターが開発されました。本研究では、PDOを用いて固形がんにおけるT細胞の有効性を定量化するワークフローを構築しました。バイオリアクターで増殖させた**患者由来大腸がんオルガノイド(CRC)**に、活性化ヒト末梢血単核細胞(PBMC)を384ウェルマイクロタイタープレート内で添加し、3日間にわたり4時間ごとにハイコンテントイメージングで観察しました。T細胞による形態変化を定量化するため、まず透過光(TL)チャネルを用いて各オルガノイドをU-netベースのディープラーニングモデルでセグメンテーションし、各オルガノイドから特徴量を抽出しました。得られた特徴量は、形態変化を受けたオルガノイドと非変化オルガノイドを識別するように訓練されたランダムフォレストモデルにより分類されました。このアプローチにより、刺激PBMCを添加したウェルでは、コントロールと比較して形態変化を示すオルガノイドの割合が約2日以内に急速に増加し、その後は変動しながらも高い水準で推移することが確認されました。これは、ラベルの有無にかかわらず、T細胞の有効性をライブで評価する手法としての可能性を示唆しています。本研究の結果は、バイオリアクターで増殖させたオルガノイドと解析手法を組み合わせることで、大規模なT細胞スクリーニングにおける有用性を示しています。
使用装置および方法
ワークフロー
バイオリアクターで増殖させた患者由来大腸がんオルガノイド(CRC)は、まず80%のMatrigelと混合され、48時間培養された後に回収されました。回収した大型オルガノイドは3%のMatrigelと混合し、**384ウェルの超低接着性フラットボトムプレート(Corning製)**に播種しました。解凍したPBMC/T細胞は、PMA/iで6時間刺激した後、CRCオルガノイドに添加して共培養を行いました。観察には、**スピニングディスク共焦点ユニットおよびsCMOSカメラを搭載したImageXpress® Confocal HT.ai ハイコンテントイメージングシステム(モレキュラーデバイス)**を使用し、4時間ごとにタイムラプスライブイメージングを実施しました。
自動化システムの構成
**インキュベーターとハイコンテントイメージング装置から構成される自動化ワークセル(図2、緑枠)**を用いて、オルガノイドとT細胞の共培養をモニタリングしました。**Generaスケジューリングソフトウェア(RETISOFT製)**を使用して、培養中のオルガノイドの定期的なモニタリングを実行しました。プロトコールでは、インキュベーターからプレートを取り出し、ImageXpress Confocal HT.aiに搬送して**4時間ごとにオルガノイドをイメージング(ステップサイズ10 µm、10倍対物レンズによるZスタック取得)し、その後PreciseFlex400ロボットアーム(Brooks製)**を用いてプレートをインキュベーターに戻しました。
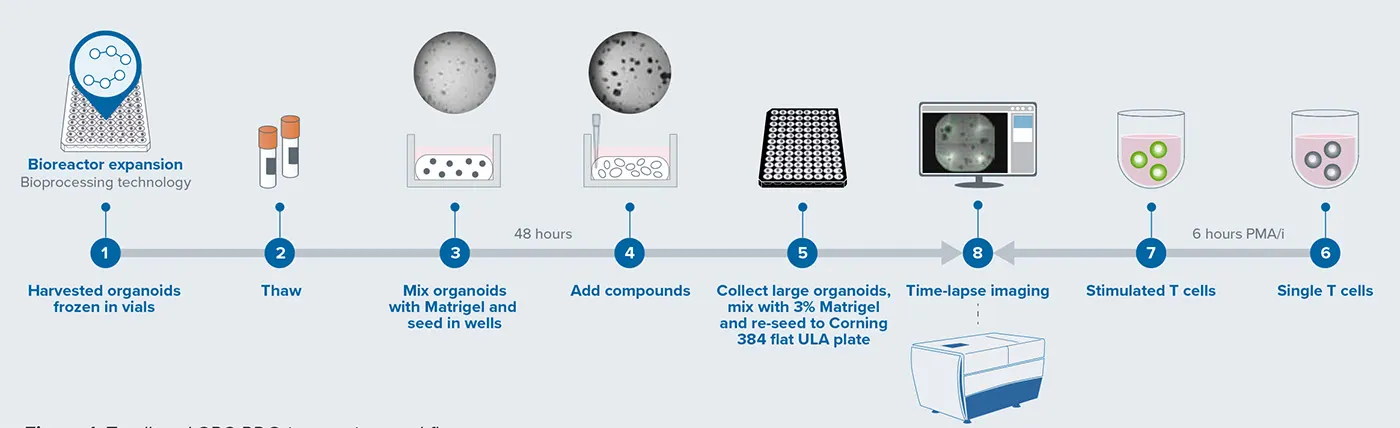
図1.T細胞とCRC PDOの相互作用ワークフロー
解析ワークフロー
HT.aiで取得したタイムラプス画像は、まず**IN Carta® 画像解析ソフトウェア(Ver. 2.4)**に対応した形式でエクスポートされました(図3A、3B)。オルガノイドは、SINAPモジュール内でオルガノイドを検出するように学習させたカスタムディープラーニングモデルを用いてセグメンテーションされました(図3C、3D)。各オルガノイドに対して50種類以上の特徴量が測定・抽出されました。解析結果は、Phenoglyphsに読み込まれました。Phenoglyphsは、画像にアノテーションを付けて特徴量をラベル付けし、オルガノイドを個別にカスタムクラスタに分類できる機械学習ベースの分類モジュールです(図3E、3F)。本解析では、オルガノイドを形態が保持されたものと変化したものの2群に分類しました。最終的な結果は**.csvファイルとしてエクスポートされ、形態変化を示したオルガノイドの割合を時間経過に沿ってグラフ化しました。SINAPおよびPhenoglyphsは、IN Carta画像解析ソフトウェアにシームレスに統合されたモジュール**として利用可能です。
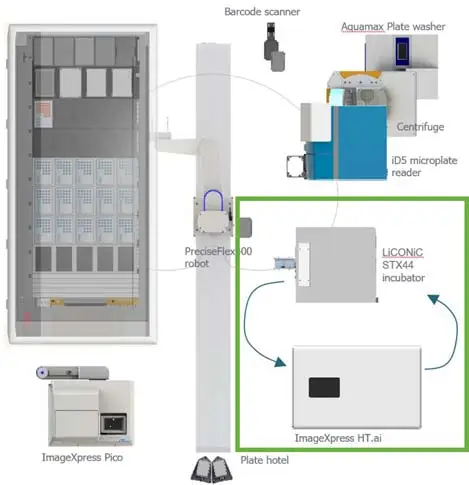
図2.自動化ワークセルの構成。この標準化されたワークフローには、液体ハンドラー(Hamilton)、ロボットアーム(Brooks)、インキュベーター(LiCONiC)、ImageXpress Confocal HT.aiシステム(モレキュラーデバイス)、ImageXpress Pico 自動細胞イメージングシステム(モレキュラーデバイス)、SpectraMax® iD5 マルチモードマイクロプレートリーダー(モレキュラーデバイス)、AquaMax® マイクロプレートウォッシャー(モレキュラーデバイス)、プレートホテル、遠心機、バーコードスキャナーが含まれます。曲線矢印は、培養中の細胞をモニタリングするプロセスの一例を示しており、プレートがインキュベーターからImageXpress Confocal HT.aiシステムに移動してイメージングされ、その後再びインキュベーターに戻される流れを表しています。
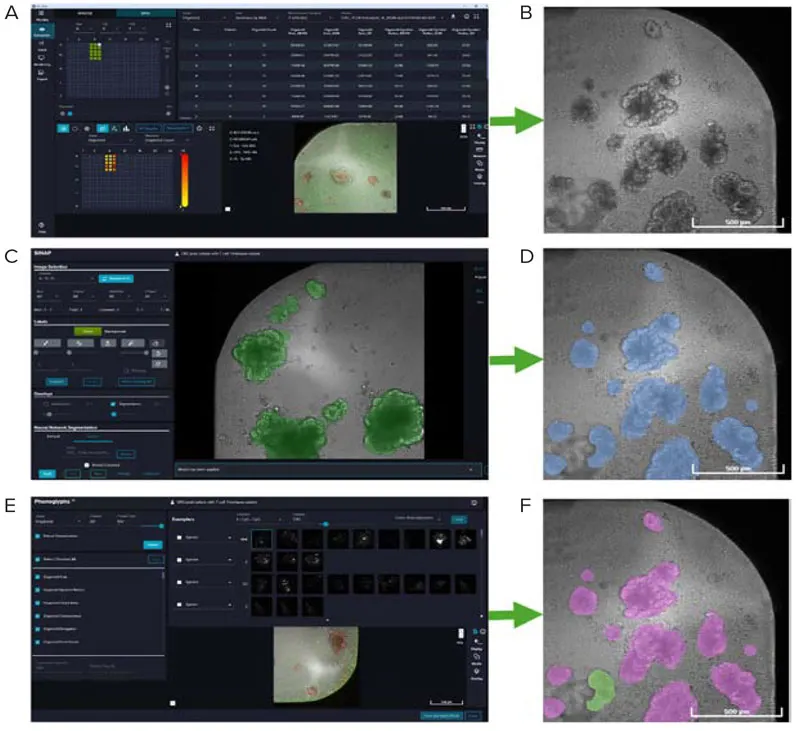
図3. A, B:取得した画像をIN Cartaにエクスポートして開いた様子。C, D:TL画像において、カスタムSINAPモデルを用いて単一オルガノイドをセグメンテーション。E, F:抽出された単一オブジェクトの特徴量をPhenoglyphsに読み込み、オルガノイドを形態保持または変化の2群に分類。
結果
SINAPによるセグメンテーション
T細胞によって誘導されるオルガノイドの形態変化およびその進行速度を記述するために、TLチャネルにおけるCRCオルガノイドを特異的にセグメント化するように学習させたカスタムディープラーニングモデルをSINAPで使用しました。SINAPは畳み込みニューラルネットワーク(CNN)モデルに基づいて構築されており、データ解析の初心者でも容易にディープラーニングベースのセグメンテーションを実行できるよう設計されています(図3C)。トレーニング画像セットの構築には、まずBrushツールを用いて5〜10枚の画像にアノテーションを付与し、既存の標準モデルをファインチューニングして初期モデルを作成しました。このモデルを用いて他のオルガノイドを大まかにセグメント化し、さらにBrushツールで修正を加えることで、50枚以上の画像からなる大規模なトレーニングセットを構築しました。興味深い点として、オブジェクトのセグメンテーションには複数のアプローチが存在し、最終的にはオルガノイドの輪郭に沿って囲まれた領域と、その輪郭に付着した断片も含めてセグメント化する方法を採用しました(図4E、4F、緑の矢印)。
トレーニングセットには、すべての形態タイプのオルガノイドを含める必要があり、これにより得られたCNNモデルは、あらゆるオルガノイドを頑健にセグメント化できます。本研究では、オルガノイドの形態を以下の2つのカテゴリに分類しました:
I. 形態が保持されたオルガノイド:泡状構造を有し、刺激あり/なしのT細胞で初期タイムポイントに処理されたもの(TLチャネルで明るく見える)、および非刺激T細胞で後期タイムポイントに処理されたもの(TLチャネルで暗く見える)(図4A–4D)。
II. 形態が変化したオルガノイド:刺激T細胞で後期タイムポイントに処理され、泡状構造を失い、TLチャネルで暗く見えるもの(図4E–4F)。
この結果は、刺激T細胞がCRCオルガノイドの構造全体に影響を与える一方で、非刺激T細胞はほとんど影響を与えないことを示唆しています。したがって、刺激T細胞による形態変化を示すオルガノイドの割合を、T細胞の有効性の指標として定量化することが可能となりました。
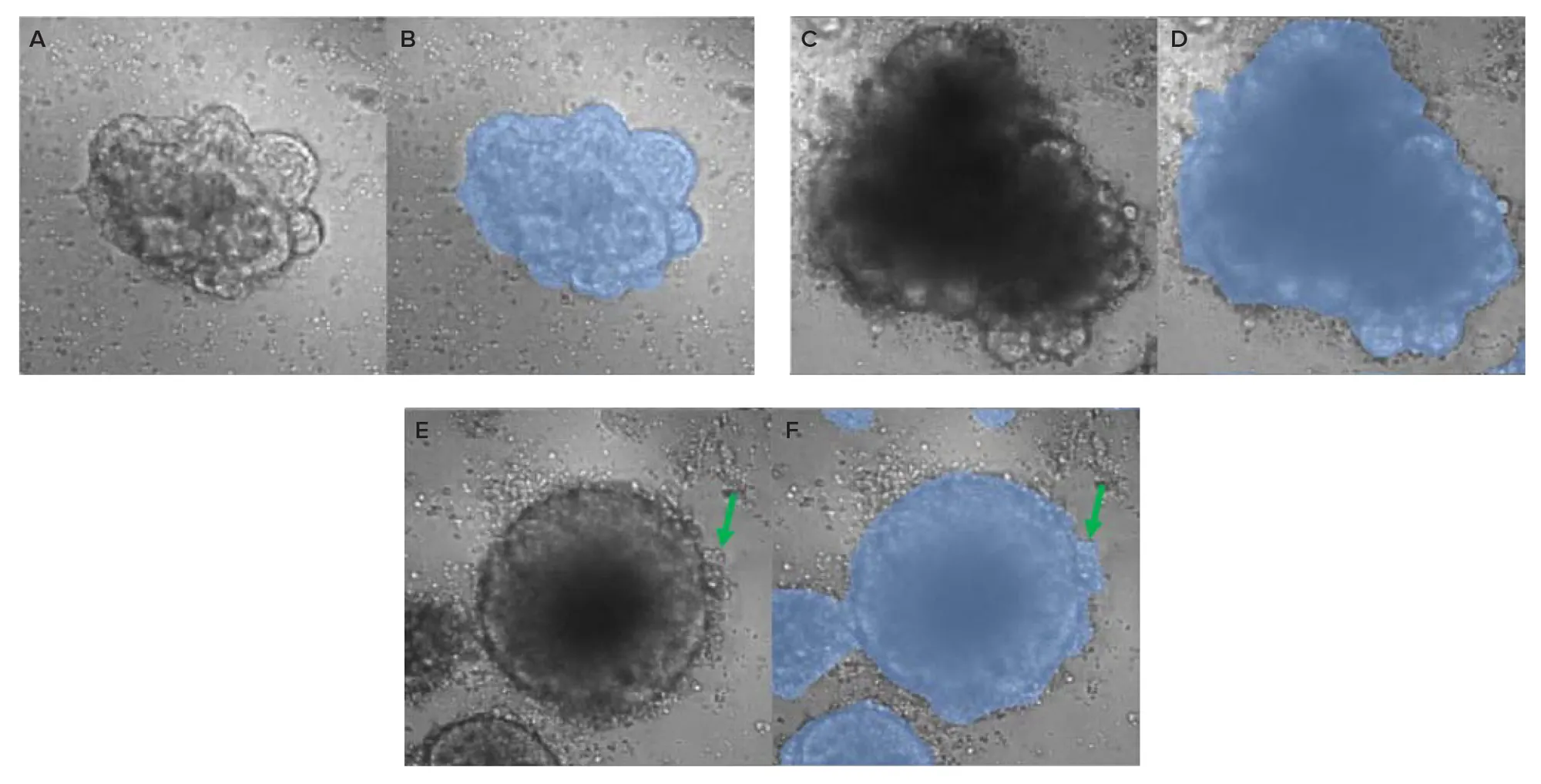
図4. A:初回タイムポイントにおける形態保持オルガノイドの代表的なTL画像 B:Aに対応するセグメンテーション結果 C:非刺激T細胞で処理した最終タイムポイントにおける形態保持オルガノイドの代表的なTL画像 D:Cに対応するセグメンテーション結果 E:刺激T細胞で処理した最終タイムポイントにおける形態変化オルガノイドの代表的なTL画像 F:Eに対応するセグメンテーション結果
Phenoglyphsによる分類
22タイムポイントにわたるTLチャネル画像から得られた数千のオルガノイドを、形態変化オルガノイドと形態保持オルガノイドの2群に分類するために、オブジェクトレベルの特徴量をPhenoglyphsモジュールに読み込みました。Phenoglyphs分類器はランダムフォレストアルゴリズムを基盤としており、画像ベースのラベリングによってトレーニングセットを構築できます(図3E)。トレーニングセットを迅速に構築するため、内蔵のk-means++アルゴリズムを用いて50のクラスタを生成し、関心のあるクラスタに対して「Changed(変化あり)」および「Unchanged(変化なし)」のラベルを付与し、一部の画像を再割り当てしました(図5A)。モデルはまず、ラベル付けされたクラス(グラウンドトゥルース)で学習され、その後、分類エラーとなったオルガノイドを再割り当てしてトレーニングセットに追加(拡張グラウンドトゥルース)することで、分類精度を向上させました(図5B)。この「クラス再割り当て → 再学習」サイクルを繰り返すことで(図5C)、モデルの性能を段階的に改善しました。このような**「人間の関与を取り入れた学習(human-in-the-loop)」アプローチ**により、効率的なモデル構築が可能となります。最終的には、F1スコアが1に達し、代表画像が両クラスで適切に分類された時点でループを終了しました(図5D)。この時点で、合計125個のオブジェクトがグラウンドトゥルースとしてラベル付けされていました。
図5Eでは、刺激T細胞で処理したウェルにおいて、形態変化オルガノイドの割合が処理後52時間以内に平均1.38%/時の速度で急速に増加し、その後は平均0.09%/時の速度で飽和傾向に移行する様子が示されています(図5E、紫の点線)。これは、刺激T細胞が52時間以内にオルガノイドの形態に強く影響を与えることを示唆しています。なお、手動でラベル付けされたグラウンドトゥルースの多くが後期タイムポイントから選ばれているため(例:図4Cと図4Eの比較)、初期タイムポイントにおけるオルガノイドの分類では誤分類が生じやすく、その結果として初期タイムポイントにおける形態変化オルガノイドの割合に一時的な上昇(バンプ)が見られることがあります(図5E、オレンジの線)。
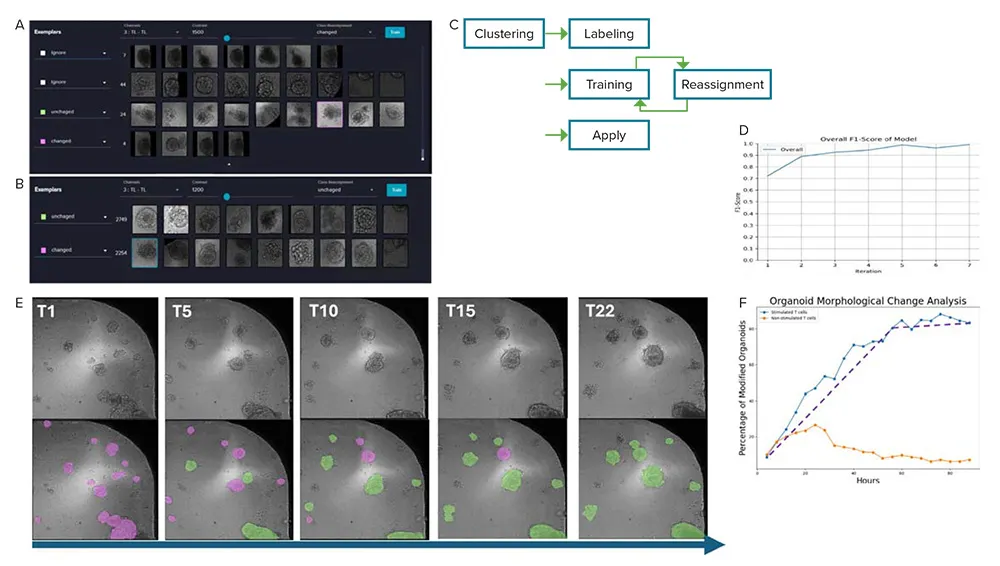
図5. A:トレーニングデータセットのラベリング開始時におけるExemplarsセクションの例 B:1回目のトレーニング完了時のExemplarsセクションの例 C:Phenoglyphsにおけるトレーニングワークフロー D:モデル品質指標F1スコアのグラフ E:分類されたオルガノイドの代表画像。時間経過に伴い形態変化オルガノイド(緑)が増加している様子を示す(ピンク:形態保持オルガノイド、緑:形態変化オルガノイド) F:刺激T細胞処理ウェル(10ウェル)および非刺激T細胞処理ウェル(5ウェル)における、形態変化オルガノイドの割合の集計結果
結論
- タイムラプス・ハイコンテントイメージングを自動化する新規T細胞ワークフローの構築に成功しました。
- 多様な形態を含むCRCオルガノイドのセグメンテーションは、カスタマイズされたセグメンテーションモデルにより良好に実施されました。
- Phenoglyphsを用いて、CRCオルガノイドを形態的特徴に基づいて正確に分類することができました。
- 形態変化オルガノイドの割合を時間経過に沿って解析する本システム全体は、ライブT細胞スクリーニング手法として有用であることが示されました。
PDF版(英語)