Application Note SpectraMaxマイクロプレートリーダーで
NanoOrange Protein Kitを活用
- 吸光度法と比較して大幅に感度が向上します
- 10 ng/mLから10 μg/mLまでの広いダイナミックレンジを実現します
- 事前設定済みのSoftMax Proソフトウェアプロトコールにより、データ取得と解析が容易です
PDF版(英語)
はじめに
このアプリケーションノートでは、Life Technologies社のNanoOrange® Protein Quantitation Kitを、モレキュラーデバイスのSpectraMax®マイクロプレートリーダーの蛍光検出モードとSoftMax® Proソフトウェアで使用する方法を説明します。このアッセイは、吸光度280、BCA、Bradford、Lowryアッセイなどの従来の比色法よりもはるかに高感度です。マイクロプレートフォーマットでの本アッセイのダイナミックレンジは10 ng/mLから10 μg/mLです。本アプリケーションノートに示すデータは、NanoOrange Kit(MP 06666)のマニュアルに記載されているダイナミックレンジと検出下限を確認するものです。
資料
- Life Technologies 社製 NanoOrangeタンパク質定量キット
- 標準曲線用タンパク質(BSA はキットに付属しています)
- 蒸留水
- 90~96℃の加熱ブロック
- プラスチックチューブ(1mLマイクロフュージチューブ)
- ソリッドブラックマイクロプレート
- Gemini XPSマイクロプレートリーダー(または蛍光検出モードを備えた他のSpectraMaxプレートリーダー)
- SoftMax Proソフトウェア
方法
装置とソフトウェアのセットアップ
ステップ1:マイクロプレートリーダーの電源を入れます。
ステップ2:SoftMax Proソフトウェアを起動します。プロトコールライブラリを開き、「Protein Quant」フォルダーを探し、事前設定済みプロトコール「NanoOrange」を開きます。
ステップ3:「Settings」をクリックすると画面が表示されます(図1)。まずRead Modeを「FL」、Read Typeを「Endpoint」に設定し、波長を選択します:励起485 nm、Emission Cutoff 570 nm、蛍光検出590 nm。左側のCategoryパネルで、アッセイプレートタイプや読み取るウェルなど、適切なパラメータを選択します。PMTと光学設定では、Automatic PMT Gainを推奨します。1回の読み取りあたりのフラッシュ数は最低20回に設定してください(フラッシュ数を増やすと精度は向上しますが、読み取り時間が長くなります)。
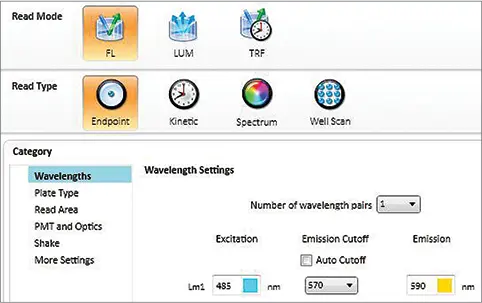
図1. NanoOrangeアッセイのプレートリーダー設定 SpectraMaxリーダーの蛍光検出モードにおける典型的な設定を示します。
ステップ4:Template Editorを使用して、ウェルを「Standards」および「Unknowns」グループに割り当てます(図2)。これにより、標準曲線が自動的にプロットされ、SoftMax Proソフトウェアでサンプル濃度が計算されます。プレートブランクを必ず含めてください。
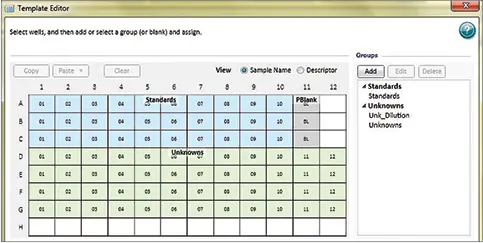
図2. テンプレート設定 Template Editorでウェルを「Standards」および「Unknowns」グループに割り当てることで、標準曲線の自動プロットとデータ解析が可能になります。
アッセイの準備
このアッセイの方法はNanoOrange製品情報シートの指示に従いますが、アッセイ容量は96ウェルマイクロプレートフォーマットに合わせて2.0 mLから180 μLに比例縮小します。
ステップ1:濃縮されたComponent B(NanoOrangeタンパク質定量希釈液)を蒸留水で1:10に希釈します(1部Component Bに対して9部蒸留水)。
ステップ2:濃縮されたComponent A(NanoOrangeタンパク質定量試薬)を、作業濃度(1x)のNanoOrangeタンパク質定量希釈液で1:500に希釈し、NanoOrange作業溶液を作製します。
注意:この操作は実験直前に行ってください(作業溶液は数時間以内に使用する必要があります)。アッセイに必要なサンプル数(標準、未知試料、ブランク、その他のコントロール)に応じて、必要量のみを調製してください。
NanoOrange作業溶液は光から保護してください。不透明なボトルに入れるか、アルミホイルで容器を包む、または暗所に保管します。光による試薬の光分解を防ぐため、光保護は重要です。
ステップ3:NanoOrange作業溶液中で2 mg/mLのBSAを希釈し、10 μg/mLおよび1 μg/mLのストック溶液を作製します。
ステップ4:NanoOrange作業溶液を用いて標準曲線と未知試料を調製します。本アプリケーションノートに示す標準曲線は、10 μg/mLおよび1 μg/mLのBSAストックを使用して作製しました。表1に示す量は、各濃度の5反復を準備するのに十分です。反復数に応じて量を調整してください。適切なBSAとNanoOrange作業溶液を混合し、光保護のために茶色のマイクロチューブに入れます(表1参照)。
| 最終BSA濃度 (μg/μL)アッセイ中 |
BSA体積 | NanoOrange 溶液(μL) |
|---|---|---|
| 10 | 1000 μL of 10 μg/mL | 0 |
| 6 | 600 μL of 10 μg/mL | 400 |
| 3 | 300 μL of 10 μg/mL | 700 |
| 1 | 100 μL of 10 μg/mL | 900 |
| 0.6 | 60 μL of 10 μg/mL | 940 |
| 0.3 | 30 μL of 10 μg/mL | 970 |
| 0.1 | 10 μL of 10 μg/mL | 990 |
| 0.06 | 60 μL of 1 μg/mL | 940 |
| 0.03 | 30 μL of 1 μg/mL | 970 |
| 0.01 | 30 μL of 1 μg/mL | 990 |
| 0(空白) | 0 | 1000 |
表1. BSA標準の調製。
ステップ5:サンプルを95°Cで10分間インキュベート(光保護)、その後室温まで冷却(約20分)、再度光保護します。
ステップ6:各サンプル180 μLをマイクロプレートの適切なウェルに移します。
このアッセイプレートでは、各BSA濃度の三重測定を行いました。
マイクロプレートの読み取り
ステップ1:マイクロプレートをプレートリーダーにセットします。
ステップ2:SoftMax Proソフトウェアで「Read」ボタンをクリックします。マイクロプレートリーダーがプレートを読み取り、相対蛍光単位(RFU)がPlateセクションに表示されます。
データ解析
ステップ1:読み取り後、RFUはPlateセクションに表示されます。データは、テンプレート設定時に作成したGroupテーブルで解析されます(「装置とソフトウェアのセットアップ」参照)。
ステップ2:事前設定済みプロトコールを使用し、適切なウェルをStandardsグループに割り当てていれば、標準曲線は自動的にプロットされます。グラフセクションのツールバーのCurve Fitメニューから適切なカーブフィットを選択します。図3に示す標準曲線のプロットには線形フィットを使用しました。
結果
図3は、キットに含まれるBSA標準を用いてNanoOrange Protein Quantitation Kitで得られた標準曲線を示しています。標準曲線の低濃度領域は図4に示しています。蛍光検出モードを備えた他のSpectraMaxプレートリーダーでも、同様のデータと曲線が得られます(データは表示していません)。
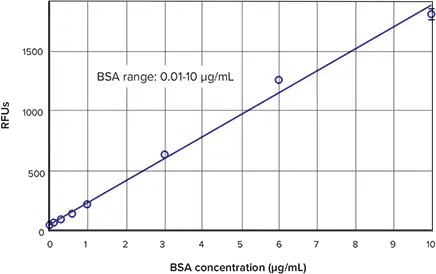
図3:NanoOrange標準曲線 BSA標準を用いて取得した標準曲線と線形フィット。
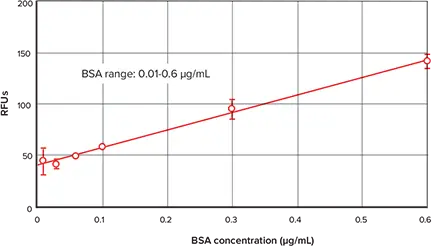
図4:標準曲線の低濃度領域の詳細 図3に示す標準曲線の低濃度部分。
結論
NanoOrangeアッセイは、Gemini XPSマイクロプレートリーダーまたはその他のSpectraMax蛍光マイクロプレートリーダーでSoftMax Proソフトウェアと組み合わせて実行することで、迅速かつ高感度なタンパク質検出法を提供します。SoftMax Proソフトウェアの解析機能により、定量結果は読みやすく、ユーザーがカスタマイズ可能なレポート形式で表示されます。
PDF版(英語)