2025/5/5
オルガノイド×AI:がん免疫回避と免疫療法のメカニズム
何十年もの間、腫瘍学の研究者たちは2つの基本的な疑問に取り組んできました: がんはどのようにして免疫系を回避するのか」、そして「どうすればがんを免疫の攻撃に対してより脆弱にすることができるのか」。患者由来オルガノイド(PDO)の登場と人工知能(AI)主導のデータ解析の組み合わせは、答えの探求に革命をもたらしています。この強力な組み合わせにより、科学者たちはがん細胞、免疫細胞、正常組織間の複雑な相互作用をより深く観察できるようになり、腫瘍免疫や治療に対する反応についてこれまでにない洞察を得ることができるようになりました *1。
患者由来オルガノイド: がん研究の可能性を広げる
オルガノイドは、従来の2D細胞培養と比較して、生体内の複雑な細胞反応や相互作用をよりよく表現する3D多細胞性マイクロティッシュです *2。従来の2D細胞培養とは異なり、オルガノイドは元の腫瘍の分子学的・生物学的特徴などの遺伝的・表現型的特徴を保持しているため、がん生物学の研究に非常に適しています。
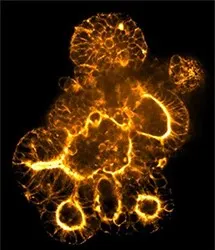
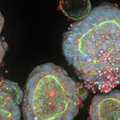
図1:結腸直腸がんPDO(Patient-Derived Organoid)におけるアクチンフィラメントをファロイジンで染色し、厚みのあるサンプルにおけるシグナルとノイズの比を向上させるためにディープティッシュ対応スピニングディスクを搭載したImageXpress HCS.ai ハイコンテントスクリーニングシステムで可視化。出典:モレキュラーデバイス
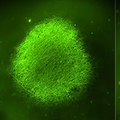
これらのモデルは、腫瘍微小環境(TME)を再現するために免疫細胞と共培養することができ、研究者はがん細胞が免疫細胞とどのように相互作用するかを制御された環境で観察することができます(図2)。
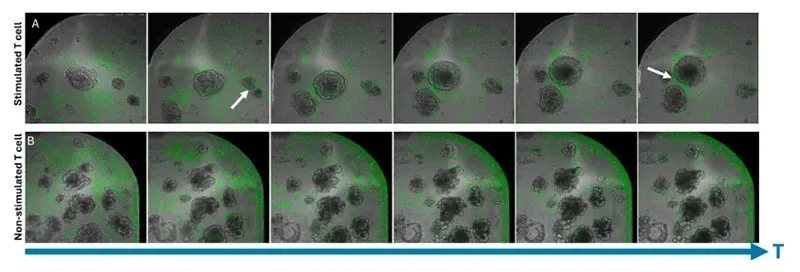
図2: T細胞とオルガノイドの培養における様々な運動性と進行性の相互作用のタイムラプスイメージ。(A)オルガノイドの縁に集積し、時間とともにオルガノイドを引き寄せる刺激T細胞 *3。(B)オルガノイドに影響を与えずにウェルの縁に集積する非刺激T細胞。
PDO技術における商業的リーダーは、これらのオルガノイドの大規模製造のパイオニアであり *4、ハイスループットな薬剤スクリーニングと免疫療法試験を可能にしています。このような進歩により、何千もの化合物を患者特異性腫瘍モデルで試験することが可能になり、効果的な免疫療法の発見が加速されます。
PDO作成における課題と最近のイノベーション
PDOは計り知れない可能性を秘めていますが、その開発にはいくつかの課題があります。PDOを作製する従来の方法は手間がかかり、専門知識を必要とし、ばらつきが大きい。さらに、オルガノイド培養の再現性は歴史的に懸念されており、大規模研究や創薬研究におけるスケーラビリティを制限してきました。
このような課題を克服するために、市販のアッセイ対応PDO株や特注のオルガノイド・ソリューションが導入されてきました。これらの標準化されたオルガノイドは、高度なバイオプロセス技術を用いて培養されるため、バッチ間の一貫性が確保され、手間のかかる培養前処理が不要になります。あらかじめ検証されたオルガノイドモデル *5 を提供することで、研究者はオルガノイド培養の複雑さよりも実験に集中することができます。さらに、テーラーメイドのソリューション *6 により、研究者は個々の腫瘍反応を忠実に模倣した患者特異性モデルを開発することができ、個別化腫瘍学研究や薬剤スクリーニングへの道を開くことができます。
がんの免疫回避メカニズムに迫る:オルガノイドとAIからの新たな知見
がん細胞は、免疫チェックポイントの活性化(腫瘍がT細胞の活性化を阻害するPD-L1のようなタンパク質を発現している場合)*7、免疫抑制性TME(がん関連線維芽細胞や骨髄由来抑制細胞が免疫細胞にとって敵対的な環境を作り出している場合)、代謝バリア(腫瘍内で乳酸が大量に産生されるとT細胞の機能が抑制される場合)など、免疫監視から逃れるためにさまざまなメカニズムを利用しています。
AIを活用した解析は、がんの免疫回避戦略の解明において重要な役割を果たしています。研究者たちは、腫瘍と免疫細胞のオルガノイド共培養系から得られる膨大なデータセットを機械学習アルゴリズムで解析しています。AIモデルは、T細胞活性化マーカーの変化やサイトカイン分泌プロファイルの変動といった免疫回避パターンを特定することが可能です。ある研究では、肺がんオルガノイドに対するAI主導の解析により、腫瘍がT細胞の活性化を抑制する経路が明らかにされ、標的治療の基盤となる知見が得られました *8。
がんの免疫療法感受性を高める戦略
免疫回避に対抗するために、研究者たちはPDO(患者由来オルガノイド)を活用し、免疫チェックポイント阻害剤やキメラ抗原受容体(CAR)T細胞療法などの免疫療法の検証と最適化を進めています。患者特異的なオルガノイドと治療用免疫細胞を共培養することで、免疫療法の有効性をリアルタイムで評価することが可能です。
最近の研究では、CAR-T細胞療法ががんオルガノイドの形態に与える影響が明らかになっています *9。AIベースの画像解析ツールを用いることで、オルガノイドの形状、サイズ、生存率の変化を経時的に追跡し、治療効果を定量的に評価することが可能です。これらのモデルにより、異なる抗原標的やエンジニアリング戦略を比較検討することで、CAR-T細胞の設計最適化が可能になります。
ハイコンテントイメージングとAIを組み合わせることで、免疫療法に反応する可能性の高い患者を予測することが可能になります。たとえば、PDO(患者由来オルガノイド)の画像を用いて学習した畳み込みニューラルネットワーク(CNN)は、腫瘍の免疫応答性に基づいて分類を行うことができます *10,*11。 このアプローチにより、個々の腫瘍-免疫環境に応じたパーソナライズドがん治療の実現が期待されています。
イノベーションを推進する最先端技術
先端技術の統合ががん研究を前進させています:
- 創薬のためのがんPDO:アッセイ準備の整った大腸がん(CRC)腫瘍塊のような利用しやすい3Dモデルは、細胞の生存率、形態、細胞骨格、ミトコンドリアに対するがん治療薬の微妙な影響を明らかにします *9,*12,*13。
- ハイスループット画像処理の自動化:ImageXpress HCS.ai ハイコンテントスクリーニングシステムのようなAIを搭載したツールは、腫瘍オルガノイドへの免疫細胞の浸潤をリアルタイムでモニタリングできる完全な環境制御を備えています *14。
- ディープラーニングによるオルガノイド分類: ディープラーニングUネットモデルを用いたAI駆動セグメンテーションにより、T細胞活性によって誘発されるオルガノイド形態の変化を正確に識別します(図3)*9。
- シングルセルRNAシーケンス: オルガノイドとシングルセルシーケンスを組み合わせることで、個々のがん細胞と免疫細胞がどのように相互作用しているかが明らかになり、潜在的な免疫療法の標的が特定されます *15。
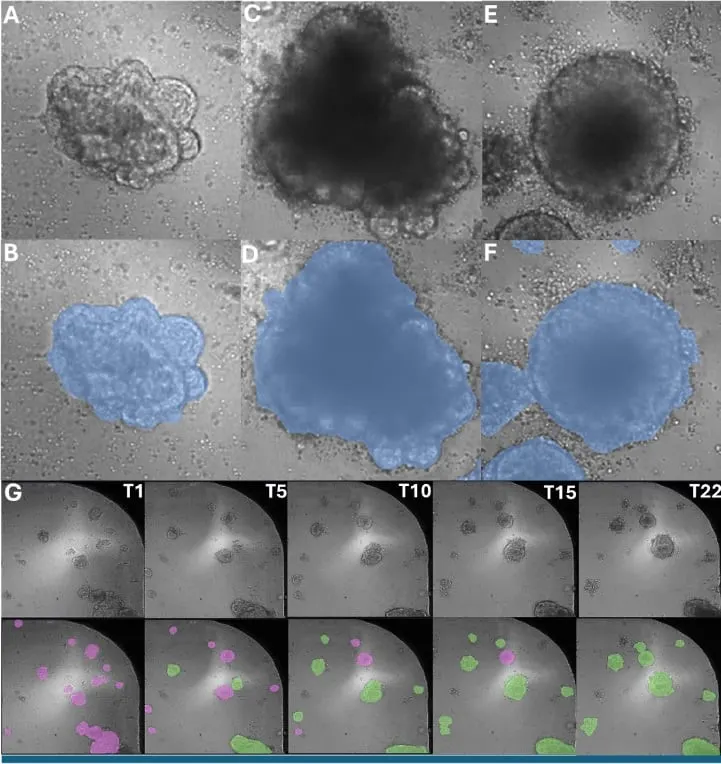
図3: A. 代表的なTL画像とB. 最初のタイムポイントにおけるインタクトなオルガノイド(非刺激T細胞と共培養)の対応するセグメンテーション。C. 代表的なTL画像とD. 最後のタイムポイントにおける無傷のオルガノイドの対応するセグメンテーション。E. 代表的なTL画像とF. 最後のタイムポイントにおける改変オルガノイド(刺激T細胞との共培養)の対応するセグメンテーション。G.刺激T細胞で処理したウェルにおいて、タイムポイントを通して修飾オルガノイドの数が増加していることを示す、分類されたオルガノイドの代表的イメージング(ピンク:無傷のオルガノイド、緑:修飾オルガノイド)。全ての解析はIN Carta™画像解析ソフトウェア を用いて実施。出典:モレキュラーデバイス *9
今後の展望と臨床応用への示唆
オルガノイドとAIの組み合わせは、がん免疫療法研究に変革をもたらしつつあります。これらの技術が進化し続けることで、真に個別化されたがん治療が可能になると期待されています。免疫療法に対する患者の反応を予測し、新たな治療標的を発見することで、オルガノイドベースのAIモデルは、実験室での発見から臨床応用への移行を加速しています。
今後数年間で、ゲノミクス、トランスクリプトミクス、プロテオミクスを含むマルチオミクスデータをAI駆動型オルガノイド研究に統合することで、さらに精密で効果的ながん治療が実現する可能性があります。臨床応用の前に患者固有の状況で免疫療法を試験できるようになれば、治療成績が劇的に改善し、治療の失敗が減る可能性があります。
まとめ
AIやPDOが免疫回避や治療抵抗性についての前例のない洞察を提供する中、がん研究は新たな時代を迎えています。これらの最先端技術を活用することで、科学者たちは腫瘍学における古くからの疑問に答えるだけでなく、より効果的で個別化されたがん治療への道を切り開こうとしています。腫瘍と免疫の相互作用に関する理解が深まるにつれ、免疫系を利用してがんを克服するという夢が、ますます具体的な現実となりつつあります。
参考文献
- Thorel L, Perréard M, Florent R, et al. Patient-derived tumor organoids: a new avenue for preclinical research and precision medicine in oncology. Exp Mol Med. 2024;56:1531–1551.
- Molecular Devices. Organoids. Available at: https://www.moleculardevices.com/applications/3d-cell-models/organoids#:~:text=Patient-derived%20tumor%20organoids%20or,and%20investigate%20cancer%20cell%20growth. Accessed February 21, 2025.
- Tong Z, Lim A. A novel workflow to quantify the interaction between T-cells and patient-derived organoids. Molecular Devices Scientific Poster. Available at: https://www.moleculardevices.com/en/assets/scientific-posters/dd/img/novel-workflow-to-assess-t-cell-and-patient-derived-organoid-interaction. Accessed February 21, 2025.
- Molecular Devices. Patent-pending bioprocess has the potential to produce tens of millions of quality-controlled organoids per batch. Available at: https://www.moleculardevices.com/technology/bioprocess-technology-for-organoid-production. Accessed February 21, 2025.
- Molecular Devices. 3D Biology. Available at: https://www.moleculardevices.com/products/3d-biology. Accessed February 21, 2025.
- Molecular Devices. 3D Ready Organoid Expansion Service. Available at: https://chat.moleculardevices.com/3dbiology-flyer-organoid-expansion-service. Accessed February 21, 2025.
- Immune Checkpoint Inhibitors. National Cancer Institute. US National Centers of Health. Available at: https://www.cancer.gov/about-cancer/treatment/types/immunotherapy/checkpoint-inhibitors#:~:text=Checkpoint%20proteins%2C%20such%20as%20PD,the%20body%20(left%20panel). Accessed March 3, 2025.
- Picca F, Giannotta C, Tao J, et al. From Cancer to Immune Organoids: Innovative Preclinical Models to Dissect the Crosstalk between Cancer Cells and the Tumor Microenvironment. Int J Mol Sci. 2024;25(19):10823.
- Tong Z. T cell-induced morphological change analysis of colorectal cancer organoids using AI. Molecular Devices Application Note. Available at: https://www.moleculardevices.com/en/assets/app-note/dd/img/t-cell-induced-morphological-change-analysis-of-colorectal-cancer-organoids-using-ai. Accessed February 21, 2025.
- Molecular Devices. IN Carta Image Analysis Software. Available at: https://www.moleculardevices.com/products/cellular-imaging-systems/high-content-analysis/in-carta-image-analysis-software. Accessed February 21, 2025.
- Sirenko O, Roberts R. Advancements in Early Toxicity Testing. Molecular Devices Podcast. February 11, 2025. Available at: https://www.moleculardevices.com/lab-notes/cellular-imaging-systems/advancements-in-early-toxicity-testing. Accessed February 21, 2025.
- Fraser E, Lim A. A case study for assay-ready patient-derived organoids (PDOs) and high-throughput 3D imaging to advance drug discovery. Molecular Devices. February 10, 2023. Available at: https://www.moleculardevices.com/lab-notes/3d-biology/case-study-assay-ready-patient-derived-organoids-and-high-throughput-3d-imaging. Accessed February 21, 2025.
- Olsen C, Tong Z, Macha P, et al. A walkaway solution for assessing drug effects in patient-derived colorectal cancer organoids. Molecular Devices. Available at: https://www.moleculardevices.com/sites/default/files/en/assets/scientific-posters/br/walkaway-solution-for-assessing-drug-effects-in-patient-derived-colorectal-cancer-organoids.pdf. Accessed February 21, 2025.
- Tong Z, Lim A. 3D quantitative measurement of T-cell penetration into cancer spheroids. Molecular Devices Application Note. Available at: https://www.moleculardevices.com/en/assets/app-note/dd/img/3d-quantitative-measurement-of-the-t-cell-penetration-into-cancer-spheroids. Accessed February 21, 2025.
- Verduin M, Hoeben A, De Ruysscher D, Vooijs M. Patient-Derived Cancer Organoids as Predictors of Treatment Response. Front Oncol. 2021:11:641980.
この記事はBiocompareに掲載されたものを許可を得て転載したものです。