2025/2/11
初期毒性評価技術の進歩【ポッドキャスト】
毒性は創薬における最も深刻な課題の一つです。臨床試験に進んだ薬剤候補の約90%が失敗し、そのうち約30%は制御困難な毒性が原因とされています *1。これは、各薬剤が10〜15年という長い期間と多大な投資・リソースをかけて開発されているにもかかわらずです。さらに、かつて承認された薬剤であっても、心臓、肝臓、腎臓、神経、または血液細胞への有害作用により市場から撤退するケースが少なくありません。このような背景から、薬剤の毒性試験に用いられる動物モデルの妥当性が問われています。動物モデルは、ヒトとは異なるゲノム構造、代謝、寿命などの違いにより、ヒトにおける毒性を正確に予測できないことが多いのです。そのため、従来の動物実験に代わる、より予測精度の高い毒性評価手法の導入が急務となっています。
Drug Target Reviewsポッドキャストの新エピソードでは、ApconiX社の共同ディレクター兼共同設立者であるRuth Roberts博士と、モレキュラーデバイスのシニア・サイエンティストであるOksana Sirenko博士が、先進的な3D細胞モデルがin vitro毒性試験をどのように改善できるかについて論じています。また、毒性試験のスピードと信頼性を向上させるためのハイスループットスクリーニングと新たな機械学習技術の役割についても議論しています。

Ruth Roberts教授は、アプコニクスの共同創設者であり、医薬品安全性研究のリーダーとして25年以上の経験を有しています。また、英国バーミンガム大学の創薬部門長兼ディレクターであり、以前はアストラゼネカの規制安全性部門グローバルヘッドを務めていました。
Oksana Sirenko博士は、モレキュラーデバイスのシニアサイエンティストで、3Dバイオロジー用の複雑な細胞ベースモデルの開発、ハイコンテントイメージング、アッセイの自動化に取り組んでいます。幹細胞由来の3Dモデルの開発と最適化を担当し、抗がん剤スクリーニングや、神経細胞、心臓血管系、肝臓の薬物毒性評価を行っています。生化学/生物物理学の博士号を持ち、15年以上の業界経験を持ち、35以上の科学論文を執筆しています。

なぜ毒性の初期発見が重要なのですか?
前例のない医薬品の毒性は、患者や医薬品開発者にとって深刻な後退です。副作用による撤回や中止は、切実に必要としている患者への供給遅延につながります。また、臨床試験に参加している患者にも悪影響を及ぼしかねません。したがって、医薬品開発パイプラインの早い段階で潜在的な毒性を検出することは、企業が合併症のリスクを軽減するのに役立ちます。
医薬品開発プロセスの後半で毒性によって医薬品が失われた場合、そのために犠牲になる動物は言うまでもありませんが、私たちは多大な資金と時間を無駄にすることになります。
- Ruth Roberts教授
多くの医薬品は何十億ドルもの投資と何年もの開発期間を必要とするため、毒性は企業のリソースに悪影響を及ぼしかねません。Roberts博士は、後期段階での毒性検出が製薬会社に与える影響を指摘しています。「医薬品開発プロセスの後半で毒性により医薬品を失うと、そのために犠牲になった動物は言うに及ばず、莫大な資金と時間を無駄にすることになります。したがって、患者にタイムリーに投与し、患者のQOLを向上させるためには、医薬品開発の早い段階で毒性試験のためのモデルを作成することが不可欠です。
高度な細胞モデルとオルガノイドが毒性試験をどのように変えるか
毒性試験の方法論は、より予測可能で信頼性の高いモデルを求めて、動物モデルから移行し始めました。その点、スフェロイド、オルガノイド、Organ-on-a-chipシステムなどの3D細胞モデルは、2Dのin vitro細胞株や動物モデルよりも正確に人体の状態を表現することができます。特にオルガノイドは、さまざまなタイプの細胞が形態学的に組織化され、細胞間の相互作用があるため、ヒトに近い状態を作り出すのに理想的なプラットフォームです」。
Sirenko博士は、オルガノイドは毒性測定において、従来のモデルに比べていくつかの利点があると考えています。「3D細胞培養は、ヒトの組織や臓器と同様に、用量依存的な反応を示す可能性があります。科学者は、神経細胞の成長や血管新生のような形態学的特性に対する薬物の影響を測定することができます。3Dモデルの感度は、細胞生存能アッセイとは対照的に、機能活性評価を通じて、より迅速かつ低濃度での毒性の検出を可能にします。
化合物のスクリーニングや毒性評価のために、生物学的に適切で予測可能な細胞ベースアッセイを開発することは、創薬における大きな課題です。FLIPR® Penta および ImageXpress® Micro Confocal システムを使用して、ロバスト性の高いマルチパラメーター細胞毒性データを取得する方法をご覧ください。
人工多能性幹細胞(iPSC)由来の心臓オルガノイドは、モレキュラーデバイスのアプリケーションにおいて、薬物毒性スクリーニングのための機能アッセイに広く使用されています。これらのオルガノイドは心筋収縮を模倣することができ、カルシウム感受性の蛍光色素を用いて可視化し、インストゥルメンテーションを用いて記録することで、薬物の心毒性を示すことができます。薬剤による毒性が生じた場合、機能的特性に変化が生じます。心臓オルガノイドでは、収縮とイオンチャネル活性の変化が、潜在的な毒性作用のロバスト性指標として用いられます。肝臓オルガノイドも、アポトーシス、脂肪沈着、オートファジーなど、人体で起こるさまざまな反応を模倣し、アルカリホスファターゼや乳酸デヒドロゲナーゼなどの分析物の分泌を変化させることで、毒性を増強しやすいです。
こうした肯定的な結果から、FDAは医薬品の安全性を評価するために動物以外の方法論を歓迎するようになりました。動物モデルは依然として主流ですが、3D細胞モデルの継続的な改良は、動物実験に付随し、最終的には動物実験に取って代わる可能性があります。
毒性試験におけるハイスループットスクリーニングの貢献とは ?
ハイスループットスクリーニングは、多数の薬剤候補の有効性と安全性を評価することができるため、創薬における重要なマイルストーンです。研究者は、多様な薬物化学と多様な標的を通して、最適な薬物と標的の条件群を見つけることができます。
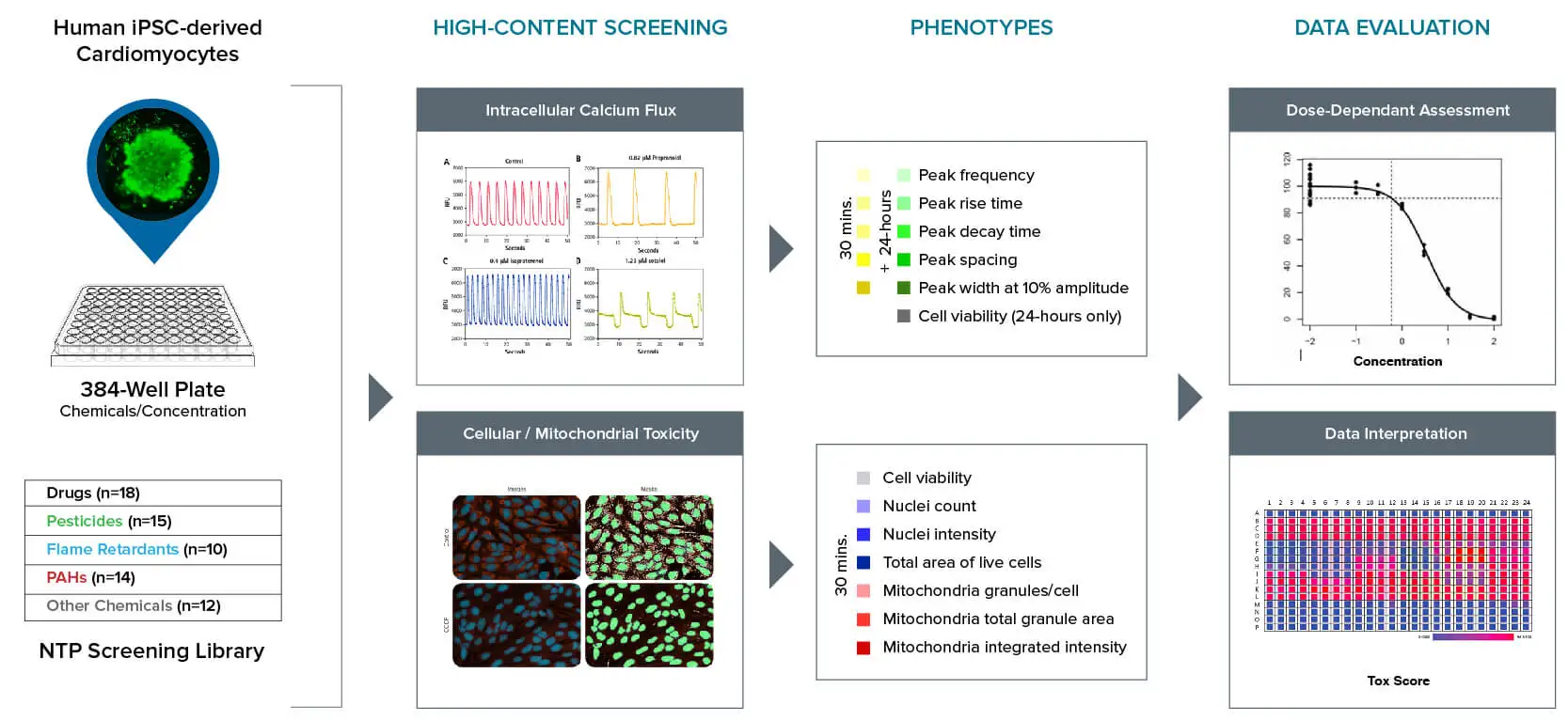
このワークフローは、ヒトiPSC由来心筋細胞を用いた統合的なin vitroアッセイによって、多様な環境化学物質および医薬品(例:NTPスクリーニングライブラリ)を対象としたハイスループットスクリーニングの手法を示しています。本研究の詳細は、「ヒトiPSC由来の器官様モデルを用いた環境化学物質のin vitro心毒性評価」をご覧ください。
Sirenko博士によれば、一定時間内に多くの薬剤候補を単離できるという利点もあります。「従来、医薬品開発のファネルでは、コストや開発ステップの後半で複数の医薬品候補を持ち続ける苦労のために、各ステップで医薬品候補を排除していました。医薬品開発の初期段階で高度な細胞モデルを用いたハイスループットスクリーニングを用いれば、早い段階から毒性の有無を判断することができます。そのため、開発の後半で毒性のある候補を排除する必要がなくなります」。全体として、ハイスループットスクリーニングは医薬品開発ワークフローの生産性とスピードを大幅に向上させます。
毒性評価における機械学習とAIの重要性
複雑化するデータの操作には、強力な分析物が必要です。機械学習アルゴリズムは、研究者が複雑なデータからパターンを推測し、薬剤の作用機序に関する知見を得るのに役立ちます。最近の人工知能(AI)の飛躍的な進歩は、診断、患者層別化、個別化医療の開発、毒性評価など、医学・医療の進歩を促進します。
先進的な創薬プロセスでは、多くの場合、化合物パネルで処理した3D生物学的モデルのハイスループット画像取得と、それに続く画像の自動解析が行われます。特定の化合物は生物製剤モデルの形態を変化させ、望ましくない毒性作用を引き起こす可能性があるため、ロバスト性と信頼性の高い方法でそのような変化を検出することが重要です。創薬におけるAIの重要なアプリケーションの1つは、画像とデータの解析です。研究者をサポートするために、モレキュラーデバイスは、複雑なアッセイに対応する最先端のAI機能を活用しながら、直感的なインターフェースを備えたIN Carta画像解析ソフトウェアをご提供しています。このソフトウェアでは、3D生物学モデルの画像から多細胞オルガノイド、細胞、または細胞内構造を検出するためにディープラーニングモデルを学習させることができます。一旦AIモデルが学習されると、IN Cartaは、パネル内の任意の化合物が、コントロール処理と比較して、ポジティブな効果を有するか、毒性を示すか、または効果がないかを識別するのに役立ちます。
HCT116細胞から形成されたスフェロイドの分類。SINAPを用いた明視野画像からスフェロイドをセグメンテーション。核、生細胞、ミトコンドリアをそれぞれ可視化するため、サンプルはさらにHoechst 33342、Calcein AM、MitoTracker Redでカウンター染色。
画像解析以外にも、毒性試験におけるML/AIの利用法はいくつかあります。実際、ロバーツ博士はアプコニクスの多数のプロジェクトに参加しています。これらのプロジェクトの1つは、薬物処理に伴う細胞モデルのトキシコゲノミック・プロファイルを予測するToxicogenomic Generative Adversarial Network(TGCAN)機械学習ツールの採用です。「私達は、多数の化合物と投与量を用いて、ラット肝臓のトキシコゲノミクス・プロファイルでモデルを訓練しました。その結果、試験を経ていない化合物のゲノム研究プロファイルを予測することができました」。さらに、ディープラーニングツールを導入して複雑な医薬品安全性評価報告書から重要な情報を抽出・照合し、医薬品毒性に関する知見を得るのに必要な時間を短縮する他のプロジェクトにも参加しました。
ハイスループット創薬のための組織特異的毒性試験
医薬品の潜在的な副作用をタイムリーに検出するためには、早期のin vitro毒性試験が不可欠です。モレキュラーデバイスは、ヒト細胞由来の最先端の3D細胞モデルを提供し、2D細胞モデルよりもヒトバイオロジーに合致した毒性プロファイルを生成します。さらに、細胞生存率と機能性を評価するための多数のアッセイからなる包括的な毒性ワークフローを提供します。これらのアッセイには、MTTアッセイ、細胞力価グローアッセイ、プレートリーダーアッセイ、イメージング、生細胞イメージング、アポトーシスアッセイなどが含まれ、心臓細胞、肝細胞、神経細胞に対する薬剤の潜在的な毒性を評価することができます。これらのワークフローは、毒性試験を迅速かつ正確に解析するために、ハイスループットスクリーニングと高度なAIツールを統合することもできます。心筋細胞、神経細胞、その他の細胞モデルのハイスループットセルラースクリーニングに注力している研究者のために、FLIPR® Pentaハイスループットセルラースクリーニングシステムは、早期の毒性評価のためのリアルタイムカイネティックアッセイをご提供します。FLIPR Pentaシステムの詳細はこちら 。
- Sun, Duxin, et al. "Why 90% of clinical drug development fails and how to improve it?." Acta Pharmaceutica Sinica B 12.7 (2022): 3049-3062.