2024/4/5
3D細胞培養イメージングの強化
スフェロイド、オルガノイド、Organ-on-a-chipなど、複雑化する3D培養は、2D培養のような従来の細胞モデルと臓器との橋渡しをしていると、モレキュラーデバイスのアッセイ開発担当シニアマネージャー、Oksana Sirenko博士は述べています。これらの培養系は、特に癌治療における個別化モデルを含む創薬や薬剤開発に使用されています。さらに、Proteintech社のProduct ManagerであるSreethu Sankar氏は、次のように付け加えています。「創薬や毒性試験における動物の使用を減らす法律を採用する国が増えるにつれて、3Dモデルの関連性は急速に高まっています。」
このイメージングシステムが主流になり、その機能が拡大するにつれて、研究室は、効率的な方法で最も多くのデータを引き出すために、培養、染色、画像化の最適な方法を解読する必要があります。顕微鏡下でイメージングする場合、特にコア付近の細胞内構造やマーカーを最もよく解明するための染色プロトコルの適応や、サンプルの厚さに関連する顕微鏡の限界などが課題になります。例えば、「3D細胞培養を長時間モニターすることは、低酸素のコア領域や、細胞から分泌される細胞外マトリックスからの高い自家蛍光のために困難です」とSankarは説明します。コーニング・ライフサイエンスのシニアサイエンティスト、ヒラリー・シャーマンは、「過剰な光散乱は画質を低下させます...さらに、従来のワイドフィールド顕微鏡は、共焦点顕微鏡に比べて3D構造のイメージングにはそれほど効果的ではありません」と付け加えています。
ここでは、3D細胞イメージングにおける一般的な障害を探り、固定または生体にかかわらず、サンプルを最適に可視化する方法を紹介します。
3D培養は2D培養とは異なります
当たり前のことのように思われるかもしれませんが、3D培養は、染色やその後の顕微鏡検査に関して、より多くの計画と工夫を必要とします。最高のイメージングを得るには、細胞が培養プレートに入る前から始める必要があります。シャーマンは、コーニングのスフェロイドプレートやコーニングのエルプラシアのような適切な培養器具を使用することを推奨しています。「ウェル間のばらつきが少ないイメージング用に設計されたマイクロプレートを使用することで、3D構造をイメージングする際に長くなりがちなウェル間のスキャン時間を大幅に短縮することができます。
Sirenko氏は、オルガノイドのセンタリングにU底プレートを使用することに賛成し、次のように付け加えています。対物レンズはイメージング中にずれることがあります。研究者は、オルガノイドをある種のマトリックス(例えばマトリゲル)の上に意図的に置いて、イメージング中に固定できるようにすることもあります。」
プレートが決まったら、"最も重要な点は、単一の細胞懸濁液から始めることです。「均一なスフェロイドは、均一な単一細胞懸濁液を使用した場合にのみ形成されます。細胞が不均一な塊やクラスタリングになっていると、空洞に均一に定着せず、結果として不均一なスフェロイドになります。小さな3D構造の方が、大きな構造よりも染色やイメージングが容易です。
最適化、最適化、最適化-染色プロトコルの再設定
スフェロイドを固定し、スライスし、スライドにマウントすることはいつでも可能ですが、労力と時間がかかります。インタクトな培養物を染色するために、条件を調整するにはトラブルシューティングが必要かもしれません。
「3D細胞イメージングでは、サンプル処理の各ステップを最適化することが非常に重要です」とSankar氏は強調します。固定や透過の時間を長くしたり、抗体のような試薬の濃度を濃くしたりして、厚い構造を補うことが期待されます」。シレンコによれば、Hoechst、MitoTracker、Calcein AMのような低分子染色剤は3D構造やマトリックスに浸透しやすいが、それでもより長い時間、(従来の培養と比較して)2〜3倍の濃度を必要とし、可能であればインキュベーター内で使用する必要があるとのこと。
ナノボディは従来のものよりかなり小さいので、オルガノイドに最適なツールです。「ナノボディは、密に詰まった3D構造の奥深くまで浸透し、(それによって)(画像の)解像度を向上させることができます」。彼はまた、Proteintech社のFlexAbleにも興奮しています。この新しい抗体標識キットは、わずか0.5ugの抗体を10分以内に蛍光色素に結合させるもので、スフェロイドのイメージングに必要な前処理時間をさらに短縮します。
サンプルを透明に
近年、様々な透明化剤が市場に出回るようになり、オルガノイドのような固定された三次元構造、厚い組織のスラブ、さらには動物全体を透明にすることができるようになりました。生物製剤サンプルはタンパク質、脂質、水の混合物であり、これらはすべて異なる屈折率(RI)を持っています。例えば、RIが高ければ、光は物質中をゆっくりと進みます。クリアリング剤は、組織の成分を除去したり変化させたりすることで、試料のRIを等しくする働きをします。
「Corning® 3D Clear Tissue Clearing Reagentのようなクリアリング液は、細胞膜やタンパク質の屈折率に合わせて細胞質や細胞間の屈折率を上げることで、画像イメージングを大幅に改善します。「これにより、光の透過性が向上し、光の散乱が少なくなります」。シレンコは、Visikolのようなウェルに試薬を加えるだけのクリアリングプロトコルを好むと指摘します。彼女はまた、強力なクリアリング剤にはより高度なプロトコルが必要で、細胞培養プレートのプラスチックにダメージを与える可能性があると指摘します。
Sankar氏は、様々な清澄化方法があることを認めつつも、研究者は代わりに拡大顕微鏡法を検討するのがよいだろうと言います。「膨張したサンプルは高い透明性を示し、光の散乱や吸収を最小限に抑えることで、大容量にわたる詳細なイメージングを容易にします。膨張樹脂のハイドロゲル様特性は、サンプル全体に埋もれたエピトープへの均一な抗体結合を可能にします。この強化されたラベリングと画像の鮮明さにより、以前は連続切片でしか見えなかったオルガノイドのコア内の複雑な詳細が明らかになります。すべての抗体がこの手法に対応するわけではありませんが、Proteintechの抗体はこのアプローチで良好に機能します。
拡大顕微鏡法には注意点もあります。ZEISSのプロダクトマーケティングマネージャーであるSamantha Fore博士によると、拡大プロセスで使用される試薬はRIを変化させ、サンプルの拡大は蛍光シグナルを希釈する可能性があるとのことです。
そこで最初のルールに戻ります:すべてを最適化することです。「染色プロトコルの最適化に時間をかけ、SB比をできる限り良くしてください。染色がうまくいけばいくほど、イメージャーがシグナルとノイズを分離しやすくなります」とシャーマンはアドバイスします。
メインイベント イメージング
適切な細胞培養プレートで、健全で、バックグラウンドが少なく、十分に染色された均一な3D培養から始めるのがベストです。サンプルが固定されている場合、クリアリング試薬や拡大顕微鏡によって、染色され、抗体標識された構造体がすみずみまで鮮明に見えることが期待されます。特に、適切な顕微鏡システム(必ずしも共焦点が含まれるとは限りません)と組み合わせることで、サンプルのイメージングが面倒でなくなるはずです。
「共焦点顕微鏡は、より厚く高密度のサンプルのイメージングには最適ですが、他にも多くの有効な選択肢があります。ZEISSのAxio Observerもその一つで、3D培養の画像化に理想的な倒立顕微鏡だと彼女は考えています。「重要なのは、アーチファクトを発生させたり、画像を非定量的なものにすることなく、高品質の光学切片を得る能力です」。Apotome 3アドオンツールは、「構造化照明法のバージョンを使用して、美しく光学的に切片化された3D画像 」を提供します。もう一つの選択肢はZEISS Celldiscoverer 7で、ワイドフィールド、共焦点、Airyscanのコンフィギュレーションがあります。この顕微鏡もハイスループットを含む生細胞イメージングに最適で、完全なインキュベーションコントロールを備えています。
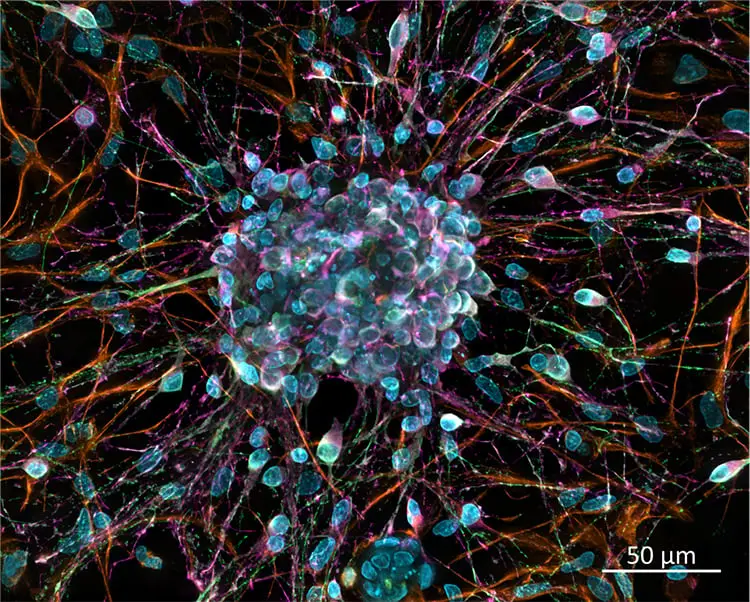
40x/0.95 autocorr対物レンズを用いたラット皮質初代培養の画像。bIII-チューブリン(Cy2)とDCX(Cy3)の抗体染色。核をDapi染色し、カバースリップで標準スライドにマウント。画像は4チャンネルZ-stackのプロジェクション(拡大焦点深度)。ZEISS Cell Discoverer 7でワイドフィールド撮影とGPUベースのデコンボリューション処理により取得。サンプル提供:H. Braun, LSM Bioanalytik GmbH, Magdeburg, Germany。
もちろん、LSM 9ファミリーや最近発売されたLattice SIMファミリーなど、さまざまな共焦点オプションがあります。Lattice SIM 3とSIM 5は、「構造化照明顕微鏡の多用途性と光学切片を活用することで、3Dイメージングを含む生細胞超解像度イメージングを簡単に行うことに特に重点を置いています。
光漂白が3Dイメージングの障害になることがよくあります。スピードと穏やかなイメージングが重要な場合、ラティスのライトシート7は光毒性を最小限に抑え、高速イメージングを実現します。
RIミスマッチは、画質を劣化させる決定的な要因であるため、引き続き注意が必要です。「ほとんど常に改善できるパラメータはRIマッチングです。これは正しい対物レンズを選択することであり、倍率だけではありません。「40倍の対物レンズはどれも同じではありません。そのため、ZEISSのマルチ液浸対物レンズは、幅広い倍率に対応しています。「水浸対物レンズとシリコン浸対物レンズの切り替えのために、新しい対物レンズを購入する必要はありません。
最後に、拡大顕微鏡が選択されたプロトコルである場合、または研究者が大きなスフェロイドやモデル系を扱う場合、Fore 氏は再び ZEISS Lightsheet 7 を提案します。
最終的な検討事項
この種の作業は膨大な量のデータを生成する可能性があり、ラボはその保存と分析方法を考え出す必要があります。Fore氏は、科学者はそれに対応するソフトウェアインフラと、「分析の再現性を高める 」AIツールを持つべきだと述べています。そのために、ZEISSはZEISS arivis Cloudというウェブベースのアプリケーションを用意しています。このアプリケーションを使えば、ユーザーはカスタムAIのディープラーニングモデルをトレーニングすることができます。同様に、3Dを分析するためのAIベースの画像セグメンテーションと閾値処理手法は、この分野を前進させ続けるとSankar氏は考えています。「3Dモデルから生成される膨大なデータをハイスループットで解析するためには、高度なアルゴリズムが絶対に必要になります。」
この記事は Biocompareに掲載されたものを 許可を得て転載したものです。