2024/5/16
CRISPR/Cas9遺伝子編集: 臨床の可能性を高める最近の進歩
がんや遺伝性疾患との関連が強いヒト遺伝子は3000以上。遺伝子変異とヒト疾患の解明は、ますます急務となっています。おそらく最も機能的なゲノム編集法は、細菌がウイルスの攻撃から身を守るためにウイルスDNAを捕獲して切断するという、適応免疫応答メカニズムに影響を受けたものと考えられます。このメカニズムは後にDoudnaとCharpentierらによってアダプター化され、ヒトのゲノム研究のために、Clustered Regularly Interspaced Short Palindromic Repeat (CRISPR)/CRISPR-associated system (Cas)と名付けられました。今日、CRISPR/Cas遺伝子編集は、標的遺伝子を明らかにし、ノックアウトを行うことで、その結果生じる表現型についての知見を提供する、遺伝子ベースの創薬に不可欠な要素となっています。この観点から、この技術は患者のゲノムと表現型を関連付け、精密医療を実現するための大きなマイルストーンです。
他のゲノム研究と同様に、CRISPR/Cas遺伝子治療も効率的で患者に優しい方法で実施されなければなりません。しかし、現在の遺伝子導入法では、オフターゲット効果や効率的なノックダウンの欠如が実証されています。
このDrug Targets Reviewのポッドキャストでは、チュービンゲン大学病院眼科研究所のPietro De Angeli博士とプリンセス・マキシマ・センターのMaarten博士が、CRISPR/Cas 9導入法の安全性プロファイルと、スケーラビリティや人工知能(AI)手法の使用を含む現在のトレンドについて議論しています。
CRISPR/Cas技術が遺伝子創薬に革命をもたらす可能性について議論しています。
注目される安全性プロファイル CRISPR/CasデリバリーにおけるDNA、mRNA、RNPs
CRISPR/Cas9遺伝子編集がシームレスに機能するためには、複合体が核に到達し、そこで標的遺伝子の位置を特定できなければなりません。
CRISPRの導入にはプラスミドDNA(pDNA)、mRNA、リボヌクレオタンパク質(RNP)が使用されますが、前者2つは安全性に課題があります。プラスミドDNAやmRNAによる導入は、しばしば自然免疫反応の活性化につながる可能性があり、pDNAには宿主ゲノムに組み込まれ、長期的な副作用につながるというリスクもあります。生体外戦略はこれらのリスクを予測し軽減するのに役立ちますが、CRISPR/Cas9の特異性は未解決のままです。
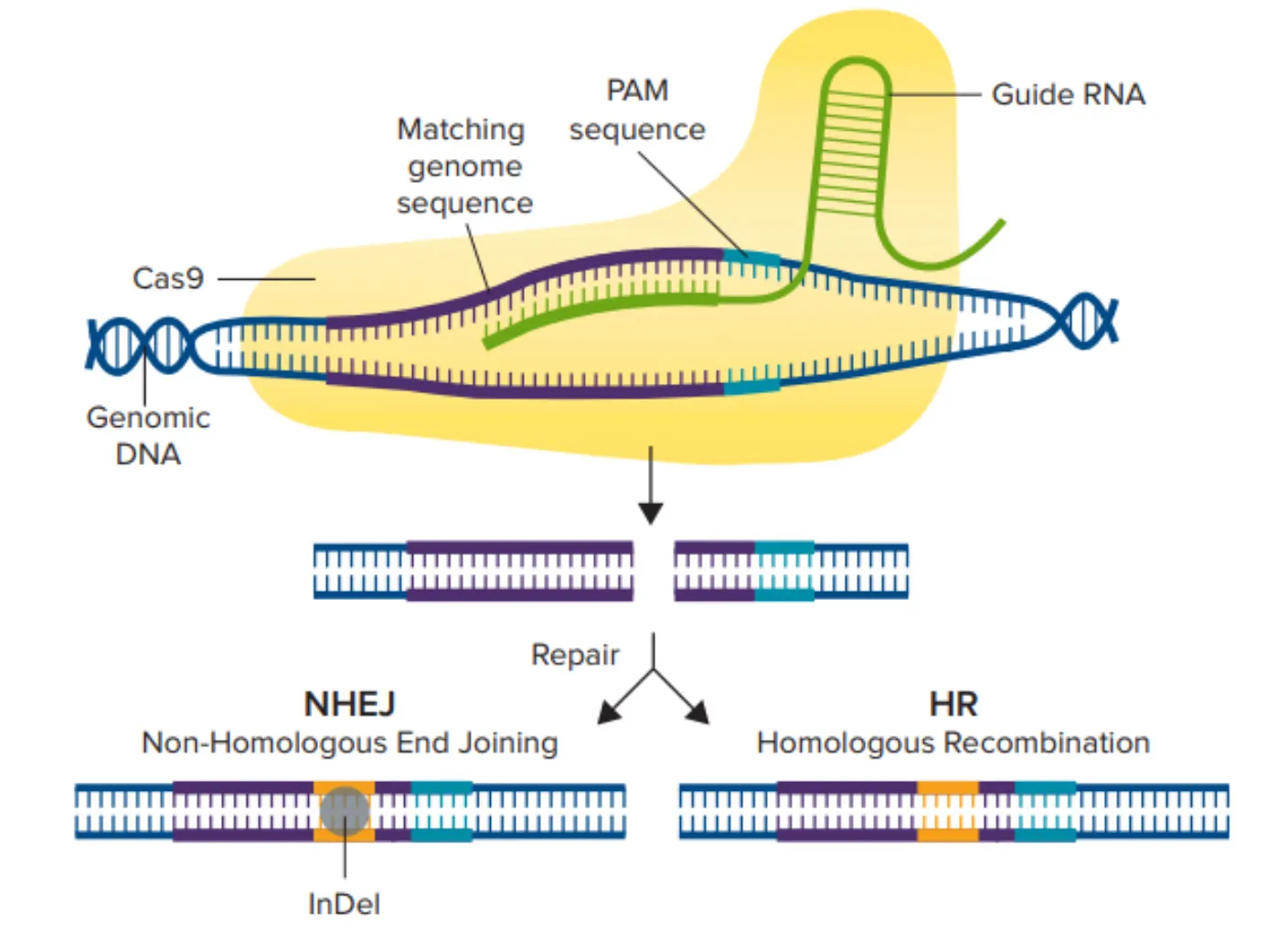
CRISPR/Cas9のメカニズム。Cas9酵素はまずガイドRNAに結合し、次に3塩基PAM配列の直前にある一致するゲノム配列に結合することで活性化されます。その後、Cas9酵素が二本鎖切断を生じさせ、NHEJまたはHDR経路のいずれかがDNAの修復に使用され、編集された遺伝子配列が得られます。
遺伝子編集のリスクを軽減するため、科学者たちはCas9タンパク質と標的gRNAの複合体からなるRNPに注目しています。この送達方法は特異性と安全性を向上させます。現在までのところ、マールテンは、複合体が宿主の中で過ごす時間とCRISPR/Cas9遺伝子編集の精度との間に逆相関があることを指摘しています: 「mRNAやDNAの場合、Cas9の転写と翻訳に最大1週間必要ですが、RNPは核に入るとすぐに活性化され、24時間以内に作業を行うことができます。Cas9が核内に長く留まれば留まるほど、オフターゲット・サイトを見つけて蓄積する可能性が高くなります。そのため、最も安全な遺伝子編集方法は、RNPを通して非常に短いCas9パルスを与えることです」。RNPのもう一つの利点は、最適化が容易であることだとPietroは付け加えています。「RNPを使用する場合、試薬の濃度を調整することが容易です。一方、DNAベースのCRISPRデリバリーでは、トランスフェクション効率とDNAコピー数を予測し、微調整することは困難です」。
RNPを使用する場合、ターゲット効率に影響を与える試薬の濃度を調整することが容易です。一方、DNAベースのCRISPRデリバリーでは、トランスフェクション効率とDNAコピー数を予測し、微調整することは困難です。
DNAまたはmRNAベースのCRISPR/Cas9がもたらすもう一つの課題は、宿主のトランスクリプトームおよびプロテオーム解析プロファイルを変化させる可能性があるということです。この変化は主に、宿主がDNAやmRNAの転写・翻訳に必要なエネルギー資源を再編成するために起こります。その結果、代謝負荷が宿主の代謝を乱し、トランスクリプトームとプロテアソームを変化させます。対照的に、RNPとしてのCRISPR/Cas9の送達は、機能し、所望の遺伝子編集を発揮する準備が整った複合体であるため、Cas9を発現する方向へのゲノム研究のシフトを引き起こしません。
生体外への応用 CRISPRのスケーラビリティと実現可能性のナビゲート
CRISPR/Cas9システムは、裸の複合体として核に送達することはできないため、適切なCRISPR送達ビークルは、複合体の完全性を保護する上で重要な役割を果たします。現在の取り組みについて、科学者たちは研究所の先駆的な研究を共有しています。
マサチューセッツ工科大学(MIT)とハーバード大学のブロード研究所の副学部長であるDavid Liu教授は、複合体を封入できるウイルス由来の脂質ナノ粒子(LNP)をエンジニアリングしました。LNPは、あらかじめ形成されたRNPを含むCRISPR/Cas9のすべての形態において、効率的な送達を実証しました。この機械は、目的の特異性臓器への複合体の送達を誘導しました(Banskotaら、2022、セル185、250-265)。一方、Jennifer Doudnaの研究室では、タンパク質のC末端とN末端に核局在シグナルを付加することで、Cas9の部位特異性を強化。In vivo実験では、マウスの脳における正確な遺伝子編集が確認された(Stahl EC, et al. 2023 Aug 2;31(8):2422-2438)。
デリバリー法は改良され続けていますが、CRISPR/Cas9遺伝子編集の臨床的可能性はまだ十分に発揮されていません。非ウイルス性導入法の中でも、エレクトロポレーション法はRNPと互換性のある安全でロバスト性の高い導入法として際立っています。この方法は細胞膜に孔を形成し、RNPの細胞質へのシームレスな侵入を可能にし、エンドサイトーシスやエンドソームからの脱出を防ぎます。
Pietroは、gRNAのスケールアップにはリスクがつきものだと考えています。「今のところ、私が問題視しているのは技術そのものではなく、法的枠組みです。...希少疾患の治療のためには、学術機関や非営利の研究機関は、患者のアクセスを容易にするために労力を費やさなければなりません」
拡張性に関しては、別の問題が浮上します。Cas9エンドヌクレアーゼはそれほどコストをかけずに大量生産が可能ですが、ガイドRNA(gRNA)は疾患や治療法だけでなく、個人にも特異性があります。Pietroは、gRNAのスケールアップにはリスクが伴うと考えています。「現時点で私が問題視しているのは、技術そのものではなく、むしろ法的枠組みです。大手製薬会社は、商業的に可能な機会を求めているため、より一般的な疾患に焦点を当てています。このグループに属する患者は、遺伝子編集治療にアクセスできる可能性が高くなります。希少疾患の治療のためには、学術機関や非営利の研究機関は、患者アクセスを容易にするために労力を費やさなければなりません」。Maartenによれば、希少疾患の規制手続きは異なる必要があります。世界中の患者数が限られている希少疾患の場合、このような包括的な報告書を作成することは不可能です。現在、Jennifer DoudnaをはじめとするCRISPRの専門家が主催するイニシアチブが、希少疾患の前臨床データ要件とIND申請を緩和するためにFDAと連携しています。" この提案では、遺伝子編集を生体外で使用し、編集したセルを生成して患者に投与し直すことで、ゲノム研究を医薬品ではなく試薬とみなすというものです。
CRISPR精密医療の強化: CRISPR/CasとAI・MLの相乗効果
機械学習(ML)とAIツールは、他の多くの産業における影響と同様に、遺伝子編集と遺伝子駆動型創薬におけるゲームチェンジャーと考えられています。CRISPR/-Cas9の場合、部位特異性およびオフターゲット編集の大規模なデータセットを収集し、これらを異なるベースエディターや3D RNP構造と関連付けるために使用することができます。機械学習アルゴリズムは、特定の遺伝子を標的とするために必要なgRNA配列と、特異性レベルを達成するために必要なタンパク質レベルでのすべての仕様を与えることができます。こうして、科学者は最も安全で最も効率的なgRNAを設計できるようになりました。
Maartenは遺伝子ベースの創薬におけるAIの価値を強調しています: 「何百ものCas9とgRNAの組み合わせをスキャンして、最もパフォーマンスの高いトップ10を検出するのに役立っています。」
AIツールは、CRISPR/Cas9のより進化した変異体の有効性を予測するためにも使用されています。プライム編集を改善するために、研究者たちは、点突然変異、挿入、欠失などのさまざまなゲノム編集を効率化するために、逆転写酵素にCas9ニッカーゼを融合させたnCas9を開発しました。この新しいシステムは理論的にはより優れたプライム編集効率をもたらしますが、その設計と安全性は徹底的に評価されなければなりません。Maartenは、遺伝子ベースの創薬におけるAIの価値を強調: "何百ものCas9とgRNAの組み合わせをスキャンして、最もパフォーマンスの高いトップ10を検出するのに役立っています"。
CRISPRの未来: 治療アプローチの形質転換
従来の遺伝子シーケンシングでは、疾患の遺伝的背景を解明するには不十分です。研究者は1人の患者から細胞を分離し、そのゲノムを健康なものと比較することができますが、この比較は必ずしも疾患の表現型に寄与する何千もの点突然変異をカバーするものではありません。CRISPR/Cas9ゲノム編集は、このような障壁を克服するのに役立ち、正確な疾患モデリングと特異性変異を標的とする個別化医療に大いに役立ちます。Pietroにとって、治療はコインの一面でしかありません。人工多能性幹細胞(iPSC)由来のオルガノイドのような3D細胞モデルは、複雑なヒトのバイオロジーをエミュレートするのに非常に価値があります。ですから、iPS細胞のゲノムに疾患関連変異を導入することで、疾患の表現型に分化できる細胞培養物を作製することができるのです」。CRISPR/Cas9のこの側面は、強力な治療ツールを開発するためには、疾患の遺伝的背景が最も重要であるため、注目に値します。
「治療手段としてだけでなく、病気研究の手段としても使えるのです。... つまり、iPS細胞のゲノムに疾患関連の変異を導入することで、疾患の表現型に分化できる細胞培養物を作製することができるのです。」
もちろん、3D細胞モデリングの役割は誇張しすぎることはありません。3D細胞培養技術とCRISPR/Cas9によって、研究者は、わずか数人の患者から抽出した細胞でゲノム全体を網羅するアイソジェニック細胞モデルを作製することができます。
結論 - CRISPR研究と応用における次のステップ
CRISPR/Cas9がもたらす治療の可能性は、特に点突然変異の編集や生体外での遺伝子修復、そして将来的には生体内での遺伝子修復など、多岐にわたります。これにより、これまで標的とすることが困難であった変異を持つ希少疾患の患者への治療アクセスを拡大することができます。
注意しなければならないのは、CRISPRは万能ではないということです。特に癌について語る場合、CRISPRは化学療法的アプローチの価値を無効にするものではありません。それに対してCRISPRは、病気のゲノム研究を掘り下げることで相乗効果を生み出し、一方で薬剤化合物は化学酵素レベルで病気に関連するメカニズムを阻害します。CRISPRをFDA認可の薬剤と組み合わせることで、がん治療の臨床応用の主流への参入を加速させることができます。
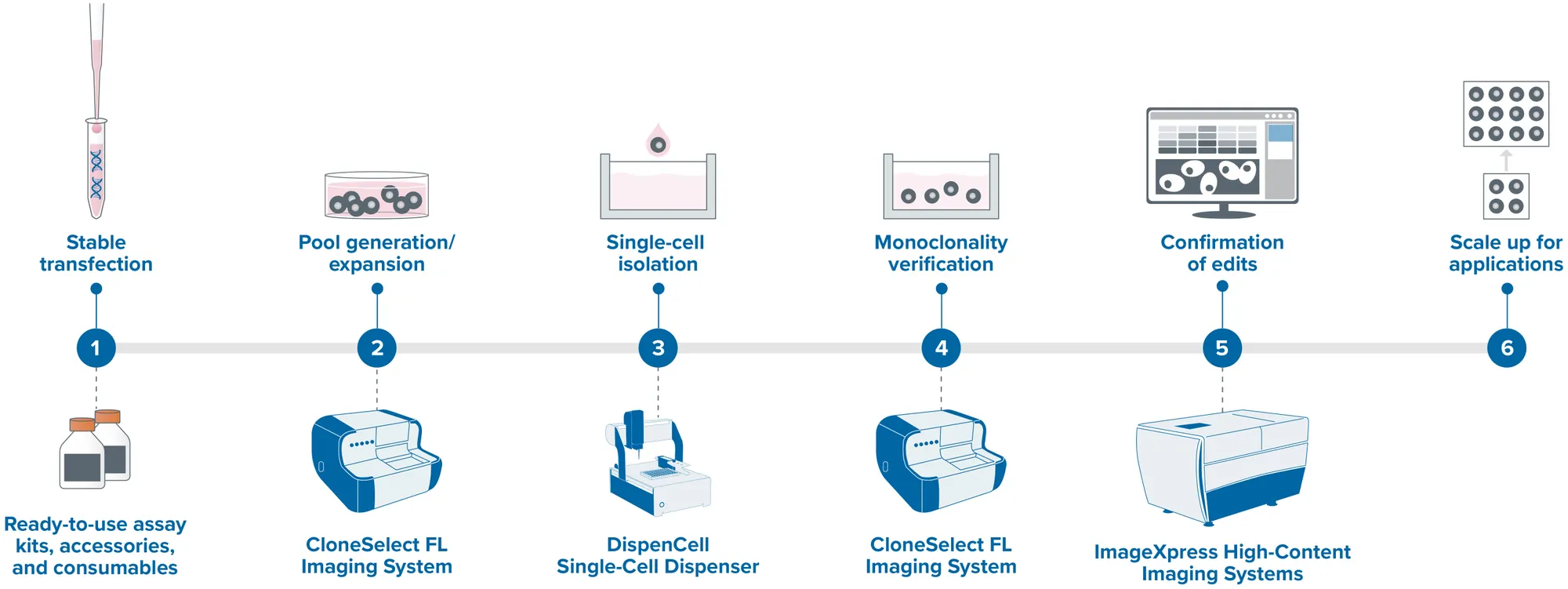
ポッドキャストでは、RNP、人工ウイルス粒子、ナノ粒子製剤を含む革新的なCRISPR送達方法について探求し、CRISPR-Cas9アプリケーションを臨床使用に近づける可能性を強調しました。強調されたのは、正確で効率的な遺伝子編集技術の必要性です。これらの科学的進歩をサポートするために、モレキュラーデバイスのImageXpressハイコンテントイメージングシステムは、細胞内のこれらの送達メカニズムの詳細な観察を可能にすることにより、重要な洞察を提供します。さらに、SpectraMaxマイクロプレートリーダーやFLIPR Pentaシステムのようなツールを統合することで、特にオルガノイドのような複雑なモデルを扱う場合、細胞の成長、維持、機能性の理解が深まります。研究プロセスを合理化することの重要性を議論する一方で、現代のラボにおける自動化の役割についても触れました。CellXpress.ai自動細胞培養システムのようなソリューションは、細胞培養プロセスの自動化をサポートし、科学研究においてより信頼性が高く再現性のある結果に貢献します。クローン・スクリーニング中のIND申請を合理化する自動化ソリューションとしては、ClonePix 2 自動動物細胞コロニーピッキングシステムなどがあります。カスタムラボオートメーション・ソリューションは、CRISPR-Cas9研究の特異性ニーズに合わせてワークフローを適合させることにより、画期的な科学的発見の追求と技術的能力をアライメントする、科学者とのコラボレーション方法として言及されました。