2024/2/16
肝臓由来オルガノイドと自動化スクリーニング技術のマッチングを見出す新たな共同研究
このような研究は、疾病研究と医薬品開発の飛躍につながる可能性があります
今年のSociety of Automation and Screening (SLAS)カンファレンスで、世界的な科学技術イノベーターとその事業会社の1社から、興味深くエキサイティングな進展がありました。ダナハーは、同社の肝臓オルガノイドとモレキュラーデバイスの自動細胞培養ソリューションを用いて、創薬プロセスにおける薬剤誘発性肝障害を予測するための、シンシナティ小児病院メディカルセンターとの新たな共同研究を発表しました。
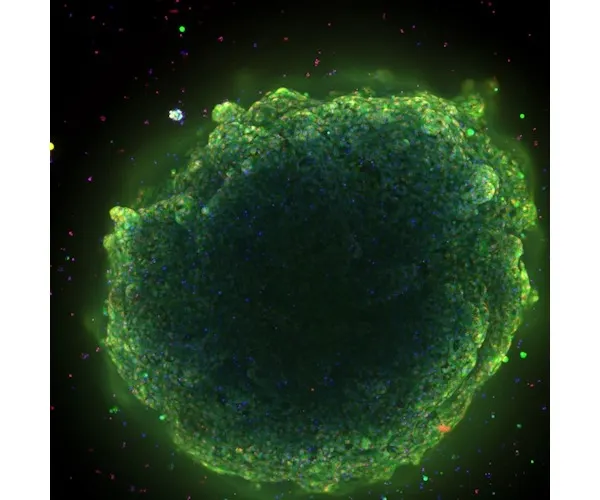
肝臓オルガノイドは、前臨床段階で薬剤性肝障害をおよそ80%の精度で予測します。オルガノイドを用いた薬剤性肝障害の予測は、薬剤の安全性を向上させ、新しい治療法の発見を加速し、薬剤障害の主な原因をより迅速に特定することができます。ダナハー、モレキュラーデバイス、シンシナティ小児科の幹細胞・オルガノイド医学センター(CuSTOM)の協力により、肝臓オルガノイドのスケールアップ生産を可能にするハイスループット技術が実現します。これには、細胞バンクを構築し、ヒトの遺伝子をよりよく反映させ、臨床試験における多様性を向上させる構想も含まれています。
Q&A
モレキュラーデバイスは、オルガノイドの開発とスクリーニングの自動化を相乗的に推進するキャンペーンを主導してきました。私たちは、モレキュラーデバイスの戦略・イノベーション担当副社長であるShantanu Dhamija氏にお会いし、この新しいコラボレーションと、これらのオルガノイド・スクリーニング・プラットフォームが将来の医薬品開発と疾患研究にもたらす期待について詳しく伺いました。
デイモン・アンダーソン、LabX:
モレキュラーデバイスはCincinnati Children's Hospital Medical Center (CCHMC)のCenter for Stem Cell and Organoid Medicine (CuSTOM)と共同で、スクリーニング用途のiPSC由来肝臓オルガノイドを開発しています。この取り組みについて詳しく教えてください。
モレキュラーデバイス、シャンタヌ・ダミジャ氏
オルガノイド科学を発展させるために私たちが抱いている中核的な信念は、オルガノイドの生成から当て推量を取り除くことです。CellXpress.aiプラットフォームのような自動化技術の設計は、その信念を支えるものです。例えるなら、このテクノロジーは、細胞を入れるとオルガノイドが出てくるオーブンのようなものです。オーブンに例えるなら、すぐに使えるケーキミックスが理想的なアプローチです。このエンドツーエンドを達成するために、私たちは、スクリーニング・ツールとして使用するためにスケールアップする際に再現性と一貫性を確保できるよう、標準的な方法と品質管理を浸透させることによって、次のレベルに引き上げることに注力してきました。
ここで、シンシナティ小児病院医学センターの幹細胞・オルガノイド医学センター(CuSTOM)が登場します。このグループがパートナーとしてユニークなのは、小児患者や肝移植患者など、必要とする人々にオルガノイドを提供するためのオルガノイド医療を実現するという、臨床的使命に駆り立てられた幹細胞研究機関としての立場です。患者の治療というエンドポイントに到達するためには、スクリーニングにオルガノイドを採用する際に関連するすべての問題-スケール、スループット、再現性、一貫性-が関係してきます。CuSTOMのユニークな点は、イノベーターが新しい方法を開拓し、成功したプロトコルに到達した後は、信頼性の高いオルガノイド開発ワークフローの合理化と最適化にかなりの時間を費やしている点です。メソッドをより効率的でスケーラブルなものにするために労力を費やすことに、ファンファーレや学術的栄光はあまりありません。しかし、このような作業は、臨床オルガノイド・パイプラインを構築するというCCHMCの使命に直結します。
私たちはかなり長い間、彼らのパートナーです。私たちは、彼らがCuSTOMラボで使用しているオートメーションのセットアップを支援しました。私たち自身のオルガノイド技術プラットフォームの開発が進行中であり、肝オルガノイドのスケーラブルな生産を可能にするために、この共同研究を立ち上げることは正しいことのように思えました。
LabX:
ダナハー・ビーコンプロジェクトとして、この共同研究は、モレキュラーデバイスの自動化されたAI主導のハイスループットスクリーニングソリューションと、CCHMCのCuSTOM社のiPSC由来肝臓オルガノイドを活用しています。ダナハー・ビーコンの戦略的パートナーシップは、デューク大学との遺伝子治療イノベーション・プログラムなど、過去にもありましたね。ビーコンプログラムについて、どのように構想され、どのような目標を掲げているのか、詳しく教えてください。
SD:
ビーコンプロジェクトは、ダナハーの形質転換を象徴するものです。モレキュラーデバイスを含め、ダナハー傘下の事業会社はすべて独立して機能しています。ダナハーは、こうした社内リソースの知識やスキルを活用して、事業会社全体を支援する機会をつかみました。これは、ハーバード・ビジネス・スクールのケーススタディにもなっています。
ダナハーが多角的な科学・診断企業へと発展するにつれ、ダナハーは最先端の技術や科学に投資する機会を求めてきました。ビーコンプロジェクトは、学術機関との協力関係を促進し、研究を促進することを目的としているため、通常のビジネス・パートナーシップとは異なります。
ダナハーが最近発表したもうひとつのビーコンプロジェクトは、カリフォルニア大学バークレー校のInnovative Genomics InstituteおよびJennifer Doudnaの研究室とのものです。ライフサイエンス産業に携わる私たち全員にとって、患者の生活向上にインパクトを与えることは大きな使命です。それがこのビーコンです。希少疾患研究を支援する遺伝子治療についてであり、将来、より大規模な技術導入の助けとなるものです。遺伝子治療開発のための安定した技術は、より大規模で複雑な疾患にも適用することができます。
LabX:
モレキュラーデバイスはこのほど、プロセスを自動化し、ワークフローを改善し、アッセイの信頼性と再現性を高めるAI主導の細胞培養イノベーションハブとして、新しいCellXpress.ai自動細胞培養システムをリリースしました。これは、ImageXpressハイコンテントイメージングとリキッドハンドリングおよびマイクロプレートリーダーデバイスを統合したオルガノイド開発自動ワークセルに続くリリースです。新しい肝臓オルガノイドはこれらの技術と互換性があるのでしょうか?また、3D Ready Organoid Expansion Serviceの一部として提供されるのでしょうか?
SD:
私たちは、お客さまが現在取り組んでいるところに対応したいと考えています。複数のモデルを想定しています。これには、特定のお客様が、ご自身のオルガノイド培養を拡大できるような材料をお求めになるシナリオも含まれます。また、「特異性患者用のオルガノイドはありますか?」と言ってくるお客さまもいらっしゃるでしょう。そのようなオルガノイドも提供できるようにしたいと考えています。
LabX:
3D細胞モデルや自動細胞培養・スクリーニングの強みを活用するだけではありません。複雑な3Dバイオロジーをスケールアップする際の課題について、コメントいただけますか?
SD:
方法、培地、プロトコルを微調整するために、かなりの量の作業を前もって行う必要があります。これは、何かが革新的なモデルから主力技術へと進歩するための基本的な側面です。例えば、ある患者のセルに特異性レベルで作用するように最適化された方法が、別の患者に合うように条件を調整する必要がないとは限りません。スケーラビリティの問題に対処するために必要なのは、大規模な患者サンプル集団で機能する適切な方法と条件を見つけることです。これがCuSTOMが完成させる作業です。完成後は、細胞が穏やかに扱われ、ストレスを受けず、自発的に分化していることなどを確認するために、結果を検証する必要があります。モレキュラーデバイスは、当社のCellXpress.aiプラットフォームと専門知識を活用して支援します。
LabX:
スクリーニングや医薬品開発において、3Dバイオロジーはどのような可能性を秘めているとお考えですか?どのような障害や障害が解決される可能性があり、それによって治療薬への進歩が加速されるのでしょうか?
SD:
特異的な薬剤性肝障害など、ある種の肝臓の感受性は、遺伝的要素が大きいのです。セルが行っているのは、例えば、さまざまな民族の患者を集めた細胞バンクの設立です。これは、低リスク、中リスク、高リスクの患者からオルガノイドを作製し、試験管内で薬物治療後のシグナルが見られるかどうかをテストする対物レンズによるスクリーニング・プラットフォームの基礎となります。このアプローチを用いれば、科学者は臨床試験に入る前に、何を調べるべきか、どのように投与量を設定すべきか、どのようにスクリーニングすべきか、基本的にはどのようにリスクをより効果的に軽減すべきか、がわかるようになります。これは非常に重要なことです。皿の中の患者という概念。生体内に入る前に、実際に何が起こるかを知ることができますか?複雑なモデルやオルガノイドのような概念が真に輝くのはこの点です。

歴史的に、肝毒性などは知られていましたが、医薬品開発に関しては十分に追跡されていませんでした。肝毒性は急性肝不全につながる可能性があり、これは不可逆的なダメージです。2020年当時、私が特に印象に残っているのは、死亡事故が発生したためフェーズ2で中止せざるを得なかった2つの薬剤の臨床試験です。開発の早い段階で毒性が確認されていれば、このような事態は避けられたはずです。ミシガン大学の研究者たちは、肝臓モデル(CCHMCで開発されたオルガノイドモデルに類似)をスクリーニングアッセイとして使用していれば、試験管内で薬物の毒性が確認できたことを示し、リソースを大幅に節約し、最も重要なことは患者の命を守ることでした。
私の同僚が 「スタートレック医学 」と呼んでいます。腫瘍のような患者組織を採取し、それでオルガノイドを作り、すべての治療薬をテストするというアイデアです。今のところ、それは数年先の話です。規制の問題もありますしね。しかし、トランスレーショナル・リサーチは、その目的地に到達するための第一歩であることは確かです。
この記事は LabXに掲載された ものを許可を得て転載したものです。