2024/12/17
マルチモーダル画像解析の革新がバイオ医薬品の生産性向上に貢献
製薬業界における生産性の危機は依然として存在しますが、技術の革新、ヒトに関連した疾患モデルの使用、オミックス技術や高度なイメージング技術の組み合わせにより、有望な改善が見られます。これらの開発により、疾患メカニズムに対する科学的洞察が深まり、標的の選択が改善され、検証方法が洗練されつつあります。
バイオファーマの生産性への挑戦
2000年代初頭、製薬業界は重大な生産性危機に直面しました(1-3)。臨床試験の中止率が急増し、医薬品開発のパイプラインは停滞。新薬の上市までの期間が延びる一方で、コストは上昇。2009年にNature Reviews Drug Discovery誌に掲載された分析では、合併、買収、組織再編成、プロセス改善など、「過去60年間、企業が何をしても新薬の生産率には影響しなかった」と結論づけています(4)。
しかし、2020年代になると、驚くべき変化が起こりました。離職率が低下し始め、年間承認新薬数が増加し始めたのです(5)。2022年には、米国食品医薬品局(FDA)の新薬承認数は、2018年を抜いて2番目に高い水準となりました(6,7)。この上昇は、様々な要因がコンフルエンスしたためとされています(5)。ゲノム研究の進歩は、疾患の表現型決定や腫瘍学バイオマーカーの同定など、実用的な知見を直接応用できる閾値に達しました。人工知能(AI)、3Dプリンティング、自動化により、研究プロセスが合理化され、意思決定が強化されています。CAR T細胞やCRISPRベースの遺伝子編集のような新しい治療法は、治療に新たなフロンティアを開いています。
このような形質転換の進展の中でも、イメージング技術とマルチモーダル解析の進歩は、創薬の加速に大きく貢献するものとして際立っています。ハイスループットスクリーニング(HTS)技術と高度なイメージング手法により、研究者は複雑な生物学的モデルを表現型レベルで迅速に評価できるようになり、パイプラインの早い段階で有望でない薬剤メカニズムを排除できるようになりました。このような技術革新は、医薬品開発期間を短縮するだけでなく、コストを削減し、より効果的な治療法を生み出すことを可能にしています。
創薬におけるマルチモーダル画像解析の役割
マルチモーダルイメージング技術、特にHTS法(8) の進歩は、創薬に革命をもたらしています。注目すべき技術革新のひとつに、蛍光色素を使用して細胞の豊富な形態学的プロファイルを作成するハイコンテント画像ベースアッセイであるセルペインティングがあります(図1)。この手法により、研究者は細胞の状態を形態学的・分子学的レベルの両方で解析できるようになり、疾患生物学に対する深い洞察が得られます。
セルペインティングの予測的応用
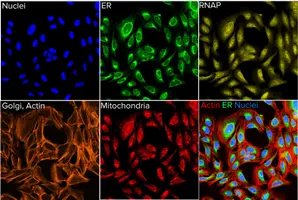
図1: セルペインティングアッセイ。細胞を化合物処理し、染色した後、ImageXpress® Micro Confocalハイコンテントイメージングシステムを用いてイメージング。コントロールウェルから取得した各チャンネルの画像例。最後のパネルは、アクチン、小胞体(ER)、核の染色を合成した画像(9) 。
セルペインティングをトランスクリプトームデータと組み合わせることで、様々な摂動が細胞機能にどのような影響を与えるかを予測することができます。マサチューセッツ工科大学(MIT)とハーバード大学(Harvard)のブロード研究所(Broad Institute)によるAnne CarpenterとShantanu Singhが率いる研究(10)などは、形態学的プロファイリングとトランスクリプトミクスを統合することで、細胞の状態について重複しながらも異なる洞察が得られることを示しています。この二重のアプローチにより、様々な治療的摂動が細胞遺伝子発現にどのような影響を与えるかを解読する能力が高まります。
セルペインティングは化合物ライブラリーの研究に利用され、化合物の多様性に関する貴重な情報を提供し、リード化合物の可能性をより効率的に同定します。がん研究においては、この手法は薬剤耐性のメカニズムを理解する上で非常に貴重であることが証明されています(11,12)。細胞が特異性薬剤に対してどのように形態学的に反応するかをプロファイリングすることで、研究者はがん細胞において耐性を誘導する可能性の高いメカニズムを特定することができ、パイプラインの初期段階で薬剤開発戦略を改良することが可能になります。
疾患シグネチャーと遺伝的機能の特定
セルペインティングは、表現型疾患シグネチャーの同定や遺伝的多様性の機能的影響の解明にも優れています。最近の研究では、肺がんなどの疾患に関連する体細胞変異の機能的影響を予測する能力が注目されています(13)。細胞形態学的バリアント影響予測(cmVIP)のような技術を用いて、研究者は遺伝子バリアントが細胞形態学にどのような影響を与えるかを決定することができます(13)。これらの知見は、遺伝的多様性と生物学的メカニズムとの関連付けにインストゥルメンテーションをもたらし、疾患の根源を明らかにするのに役立ちます。
この方法は、疾患プロファイルの遺伝子機能や化学的制御因子を同定するのに特に威力を発揮します。遺伝的・化学的摂動によって誘発される形態学的変化を系統的に解析することで、研究者は、疾患に対するこれまで明らかにされていなかった遺伝的寄与を明らかにし、潜在的な治療標的を同定することができます(14)。
毒性と化学物質のプロファイリング
マルチモーダルイメージングのもう一つの重要な応用は、薬物毒性の評価である(15)。遺伝子や化学物質の摂動によって引き起こされる形態学的変化を系統的にプロファイリングすることで、研究者は早期に副作用を予測することができます。このfail-fasterアプローチは、コストのかかる臨床試験に進む前に安全でない化合物を排除することで、資源を節約します。
スクリーニング技術の進化:失敗を早期に見極める戦略の実現
ターゲット同定とヒット化合物同定のためのスクリーニング・パラダイムに新しい技術を取り入れることで、創薬研究のペースが加速し、研究者は何千もの化合物を並行して評価できるようになりました。最近の進歩により、これらの新技術とスクリーニングアプローチのスピードと精度がさらに向上し、実行可能な薬剤候補を同定するプロセスが合理化されています。
CRISPRによる表現型スクリーニングの強化
CRISPR技術とセルベーススクリーニングの統合により、薬剤と標的の相互作用を研究する新たな道が開かれました(16,17)。特異的なゲノムターゲットを改変することで、低分子がこれらの部位にどのような影響を及ぼすかを観察することができ、潜在的な薬剤候補をより正確に同定することができます。このアプローチは、関与する生物学的経路をより正確に理解することを可能にし、研究者が最も有望な化合物に優先順位をつける一方で、実行可能性の低い候補を除外するのに役立ち、実行不可能な化合物に費やす時間を短縮します。
自動プロテオーム解析プラットフォーム
autoSISPROT(18)のような自動プロテオーム解析プラットフォームは、創薬ターゲットとオフターゲットの迅速な同定を可能にすることで、ターゲット同定に形質転換をもたらします。最大96サンプルを2.5時間未満で処理するこれらのプラットフォームは、従来の方法に比べてスループットを10倍向上させます。そのスピードと精度により、研究者はターゲットを迅速に検証することができます。
AIによるヒットの優先順位付け
人工知能は、薬剤候補に優先順位をつける機械学習アルゴリズムを通じて、ワークフローを再構築しています。偽陽性をフィルタリングすることで、これらのシステムは真に生物活性のある化合物にリソースを確実に割り当てます。このデータ駆動型アプローチは再現性を高め、コストを削減し、初期段階のスクリーニングをより効率的で信頼性の高いものにします。
複雑な細胞モデル: 前臨床研究と臨床研究のギャップを埋めるために
イメージングとHTS技術は極めて重要ですが、先進的な細胞モデルの使用も創薬において同様に形質転換をもたらしました。患者組織由来の三次元細胞モデルであるオルガノイド(図2)は、疾病メカニズムの研究や治療介入を評価するための強力なツールとして登場しました。
疾患の特性化と研究におけるオルガノイド
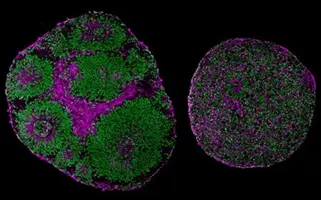
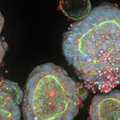
図2: ピット・ホプキンス症候群患者由来の脳オルガノイド(右)とコントロール患者由来の脳オルガノイド(左)のサイズと構造に大きな違いがあることを示す顕微鏡画像 [Credit: UC San Diego Health Sciences(19,21)]。
オルガノイドは、患者の組織から自己集合した3D細胞モデルで、臓器の構造や機能を模倣しています。二次元の細胞培養モデルに比べ、疾患メカニズムの研究に生理学的により適切なプラットフォームを提供します。例えば、患者由来オルガノイド(PDOs)(19,21)は、腫瘍の不均一性を再現し、個別化治療法を試験するために癌研究で使用されており、腫瘍生物学や治療反応に関する詳細な調査を可能にしています(21,22)。PDOをCAR T細胞と共培養することで、研究者は固形がんに対する免疫療法を最適化し、免疫回避や抵抗性といった課題に対処して有効性を高めています。
これらのヒト関連モデルは肝癌研究においても有用であることが証明されており、肝細胞癌(23)や胆管癌(22)の研究に用いられています。がん進行の初期段階を再現し、個別化された治療法を試験することで、オルガノイドは前臨床研究と臨床研究のギャップを埋め、創薬研究にスケーラブルで信頼性の高いツールを提供します。
オルガノイドのスケーラブルな生産
自動化3D培養プラットフォームのような技術は、オルガノイドのスケーラブルな生産を可能にしています。このようなツールは、新規化合物の安全性を迅速に評価したり、薬剤が疾患特異性経路をどの程度標的とするかを評価したりする上で非常に貴重です。アッセイ準備の整ったオルガノイドをスケールアップして作製できるため、研究者はハイボリュームやハイスループットのワークフローに対応する一貫したモデルを得ることができます。
特許取得済みバイオリアクターなどの技術の進歩により、オルガノイドはより利用しやすくなっています(24)。特許取得済みバイオリアクターシステムは、オルガノイドの迅速かつ再現性の高い作製をサポートし、薬物毒性試験や治療効果スクリーニングなどの用途で、複雑なヒト組織のモデル化を容易にします。この技術により、研究者は均一なオルガノイドを大量に入手することができ、従来のオルガノイド培養法にしばしば見られるばらつきの問題に対処することができます。これらの3Dモデルに合わせた高度なイメージングや分析ソリューションと組み合わせることで、ハイコンテントイメージングによる表現型プロファイルもスケールアップして迅速に実現できるようになりました。3Dレディ・オルガノイド(25)のようなソリューションを提供するための精密エンジニアリングと生物学的専門知識の統合は、研究者にin vitroとin vivo研究のギャップを埋める力を与え、実用的で臨床に関連する知見をもたらします。このイノベーションは、創薬プロセスを合理化するだけでなく、その予測力を高め、後期段階での失敗のリスクを低減します。
創薬における自動化と人工知能
AIと自動化の統合は、ターゲット同定からリード最適化まで、創薬プロセスのあらゆる段階を加速しています(26-28)。CellXpress.ai自動細胞培養システム(29)のような自動化プラットフォームは、細胞モデルの培養を合理化し、創薬の最も労働集約的な側面の1つに対処し、一貫性と拡張可能な自動化を保証します。培地交換、細胞プレーティング、継代などのルーチン作業を自動化することで、CellXpress.ai自動細胞培養システムはヒューマンエラーの可能性を大幅に減らし、実験間の再現性を確保します。高度なAI駆動アルゴリズムが細胞の増殖と形態をリアルタイムでモニターするため、研究者は手動での作業なしに培養条件について十分な情報に基づいた判断を下すことができます。このシステムは、HTSやその他のダウンストリームアプリケーションに不可欠な、アッセイレディ細胞の一貫したバッチの作製に特に適しています。ハイコンテントイメージングや解析ツールとシームレスに統合することで、これらのソリューションはワークフローを加速し、拡張性を高め、研究者の貴重な時間を実験デザインとデータ解釈に集中させることができます。
人工知能は毒性学において極めて重要な役割を果たしており、機械学習モデルを用いて薬物の毒性や有害なメカニズムを事前に予測します。これらのモデルは膨大なデータセットを活用し、in vivo試験の前に潜在的な毒性を早期に特定することで、動物実験への依存を減らし、前臨床評価を迅速化します。DeepChem Pythonライブラリ(26,30)のようなAIを活用したツールは、化学的特性を予測し、新規化合物を生成することで、薬剤スクリーニングに革命をもたらしています。このようなデジタルツールにより、研究者は有効性だけでなく安全性プロファイルも良好な医薬品を設計できるようになり、創薬プロセスがより効率的かつ正確になります。
ライフサイエンスの未来をともに創造
ゲノム解析の成熟、AI や 3D プリンティングのような先端技術の導入、イメージング、マルチモーダル解析、高度な細胞モデルなどのイノベーションにより、製薬業界は 2000 年代前半の生産性危機を乗り越えつつあります。セルペインティングのような技術は、疾患生物製剤に対するより深い洞察を提供し、HTS技術は、リソースを節約し、より迅速なアプローチを可能にします。一方、AIと自動化は、これらの進歩を効率的に適用することを保証しています。
ゲノム研究と分子生物学の知識ベースが成熟し続け、自動化された3Dバイオプリントのような新しいツールが普及するにつれて、この業界は創薬と効果的な治療法の開発における勢いを維持するのに有利な立場にあります。これらのイノベーションは、ベンチからベッドサイドまでの成功率を向上させるだけでなく、新薬をより早く患者に届け、アンメット・メディカル・ニーズに対応し、世界的にヘルスケアを形質転換することを約束します。
参考文献
- Pammolli F, Magazzini L, Riccaboni M. The productivity crisis in pharmaceutical R&D. Nat Rev Drug Discov. 2011;10:428–38.
- Scannell J, Blanckley A, Boldon H, Warrington W. Diagnosing the decline in pharmaceutical R&D efficiency. Nat Rev Drug Discov. 2012;11:191–200.
- Schuhmacher A, Gassman O, Hinder M. Changing R&D models in research-based pharmaceutical companies. J Transl Med. 2016;14:1–1.
- Munos B. Lessons from 60 years of pharmaceutical innovation. Nat Rev Drug Discov. 2009;8:959–68.
- Pammolli F, Righetto L, Abrignani S, Pani L, Pelicci PG, Rabosio E. The endless frontier? The recent increase of R&D productivity in pharmaceuticals. J Transl Med. 2020;18:162.
- de la Torre BG, Albericio F. The Pharmaceutical Industry in 2023: An Analysis of FDA Drug Approvals from the Perspective of Molecules. Molecules. 2024;29:585.
- US Food and Drug Administration. Advancing Health Through Innovation: New Drug Therapy Approvals 2022. Available at: https://www.fda.gov/media/164429/download (last accessed: December 6, 2024).
- Molecular Devices. Cellular Imaging Systems. Available at: https://www.moleculardevices.co.jp/products/cellular-imaging-systems/
- Lim A, Nishloka C, Bashkurov M. High-content phenotypic profiling using the Cell Painting assay. Molecular Devices Application Note. Available at: https://www.moleculardevices.co.jp/app-note/high-content-phenotypic-profiling-using-the-cell-painting-assay.html
- Broad Institute. Carpenter-Singh Lab. Available at: https://carpenter-singh-lab.broadinstitute.org/ (last accessed: December 6, 2024).
- Kelley ME, Berman AY, Stirling DR, et al. High-content microscopy reveals a morphological signature of bortezomib resistance. eLife. 2023;12:e91362.
- Forman B. Cell Painting in Drug Discovery: A Conversation With Assay Pioneer Anne Carpenter. Technology Networks. October 17, 2024. Available at: https://www.technologynetworks.com/drug-discovery/articles/cell-painting-in-drug-discovery-a-conversation-with-assay-pioneer-anne-carpenter-392215 (last accessed: December 6, 2024).
- Caicedo JC, Arevalo J, Piccioni F, et al. Cell Painting predicts impact of lung cancer variants. Mol Biol Cell. 2022;33:ar49.
- Recursion. Recursion OS: The Heart of Our Operations. Available at: https://www.recursion.com/technology (last accessed: December 6, 2024).
- Wu Y, Ma L, Li X, et al. The role of artificial intelligence in drug screening, drug design, and clinical trials. Front. Pharmacol. 2024;15:1459954.
- Seal S, Trapotsi M-A, Spjuth O, et al. A Decade in a Systematic Review: The Evolution and Impact of Cell Painting. bioRxiv [Preprint]. 2024 May 7:2024.05.04.592531. doi: 10.1101/2024.05.04.592531.
- Cimini BA, Chandrasekaran SN, Kost-Alimova M, et al. Optimizing the Cell Painting assay for image-based profiling. Nat Protoc. 2023;18:1981–2013.
- Wu Q, Zheng J, Sui X, et al. High-throughput drug target discovery using a fully automated proteomics sample preparation platform. Chem Sci. 2024;15:2833–47.
- Mixides T. Patient-derived organoids in disease modeling. Drug Target Review. October 16, 2023. Available at: https://www.drugtargetreview.com/article/112032/patient-derived-organoids-in-disease-modelling/ and https://www.moleculardevices.com/newsroom/in-the-news/patient-derived-organoids-in-disease-modelling (last accessed: December 6, 2024).
- Molecular Devices. Expert Perspectives in 3D Biology. Available at: https://www.moleculardevices.co.jp/lab-notes/3d-biology/expert-perspectives-on-3d-biology.html
- Fraser E, Thomas L. Using PDOS to prevent and treat cancer in FAP and MAP patients. Molecular Devices. Available at: https://www.moleculardevices.co.jp/lab-notes/3d-biology/using-pdos-to-prevent-and-treat-cancer-in-fap-and-map-patients.html
- Yang Y, Cui J, Kong Y, et al. Organoids: New Frontiers in Tumor Immune Microenvironment Research. Front Immunol. 2024;15:1422031.
- Xiao H, Liang J, Liu S, et al. Proteomics and Organoid Culture Reveal the Underlying Pathogenesis of Hashimoto’s Thyroiditis. Front Immunol. 2021;12:784975.
- Molecular Devices. Bioprocess technology for organoid production. Available at: https://www.moleculardevices.com/technology/bioprocess-technology-for-organoid-production (last accessed: December 6, 2024).
- Molecular Devices. 3D Ready Organoid. Available at: https://www.moleculardevices.co.jp/applications/3d-cell-models.html
- Sarkar C, Das B, Rawat VS, et al. Artificial Intelligence and Machine Learning Technology Driven Modern Drug Discovery and Development. Int J Mol Sci. 2023;24:2026.
- Vora LK, Gholap AD, Jetha K, et al. Artificial Intelligence in Pharmaceutical Technology and Drug Delivery Design. Pharmaceutics. 2023;15:1916.
- Chakraborty C, Bhattacharya M, Pal S, Islam MA. Generative AI in drug discovery and development: the next generation of drug discovery and development would be directed by generative AI. Ann Med Surg (Lond). 2024;86:6340–3.
- Molecular Devices. CellXpress.ai Automated Cell Culture System . Available at: https://www.moleculardevices.co.jp/products/3d-biology/cellxpress-ai-automated-cell-culture-system.html
- DeepChem. Available at: https://deepchem.io/ (last accessed: December 6, 2024)